고대의대, 미토콘드리아 유전자 편집 시대 연다…동물모델 개발
김진수 엣진 CTO 교신저자 참여

이현지 고려대 의대 융합의학교실 교수 연구팀은 엣진 연구팀과 함께 동물모델에서 'A-to-G' 유전자 교정에 성공했다고 5일 발표했다. 툴젠 창업자인 김진수 싱가포르국립대 교수(엣진 CTO)이 참여한 이번 연구결과는 국제학술지 셀(인용지수 66.85)에 실렸다.
세포 속에 있는 에너지 공급원인 미토콘드리아 내부엔 DNA가 있다. 이 DNA 서열이 잘못되면 미토콘드리아 기능이 망가져 뇌, 신경, 근육 등에 다양한 질환이 생길 수 있다. 이런 유전적 결함은 모계로 유전되기 때문에 엄마의 유전적 변이 등이 아이에게 유전돼 질환으로 나타날 수 있다.
크리스퍼 유전자 가위(CRISPR-Cas9) 기술이 DNA를 교정하는 데에 쓰이지만 특정 DNA 서열을 인식하는 가이드 RNA가 미토콘드리아 내부로 들어가지 못한다. 미토콘드리아 DNA 교정엔 크리스퍼 기술을 활용하기 어려운 이유다.
이 때문에 미토콘드리아 DNA 염기 4종류 아데닌(A), 구아닌(G), 티민(T), 시토신(C) 중 시토신(C)을 티민(T)으로 교정하는 효소(DdCBE)와 아데닌(A)을 구아닌(G)으로 교정하는 기술(TALED) 등이 개발됐다. 그동안 DdCBE로는 마우스 모델 제작에 성공했지만 아직 TALED를 활용해 성공한 동물실험 사례는 보고되지 않았다.
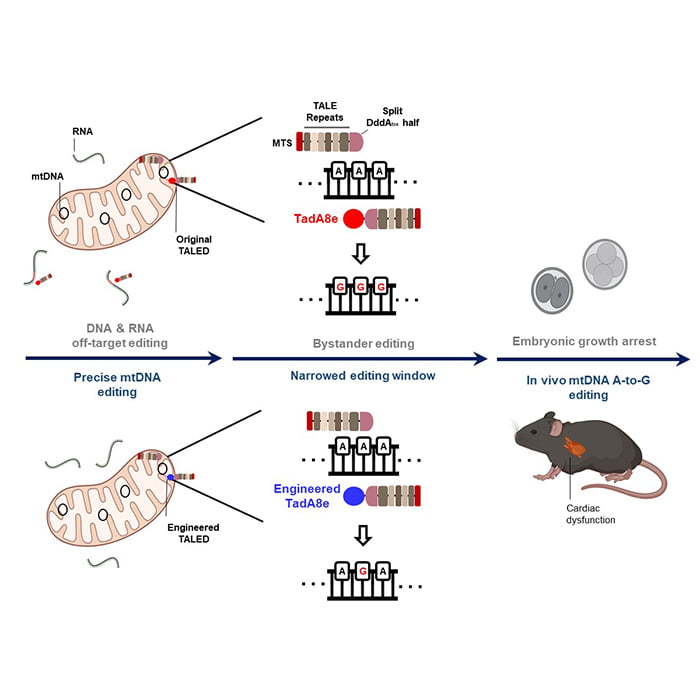
연구팀은 더 정밀한 TALED(V28R-TALED)를 개발했다. 이를 통해 TALED 부작용인 세포 내 무작위적 DNA·RNA 변형이 크게 줄었다는 것도 확인했다. 개량된 TALED를 생쥐의 수정란에 미세주입해 미토콘드리아 질환인 '리 증후군' 모델을 만드는 데 성공했다.
연구책임자인 이현지 교수는 "이번 연구는 미토콘드리아 유전자 교정기술이 치료제로 개발되기 전에 반드시 선행돼야 하는 연구"라며 "지금까지 적절한 치료법이 없었던 미토콘드리아 질환 치료 길이 열리는데 한 발짝 더 다가갔다"고 했다.
이지현 기자 bluesky@hankyung.com
-
기사 스크랩
-
공유
-
프린트





![월가 "인텔 망가졌다"…구글 9년 만에 최고의 날 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240427071917087.jpg)





![[단독] 대법원, 13년 만에 '솜방망이' 사기 양형기준 손본다](https://timg.hankyung.com/t/560x0/photo/202404/02.25002593.3.jpg)


