깐깐해진 신약 신속 허가… 2년 동안 3분의 1로 급감
3상 조건부 임상허가 건수
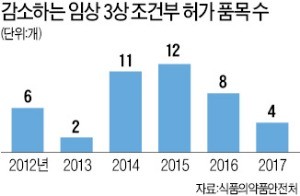
2015년 12건→지난해 4건
15일 식품의약품안전처에 따르면 지난해 3상 조건부 임상허가를 받은 의약품은 4개에 그쳤다. 2010년 2개였던 조건부 임상 의약품은 2015년 12개까지 늘었다가 2016년 8개, 지난해 4개로 급감했다.
신약 개발을 늘리기 위한 제도적 개선도 지지부진하다. 식약처는 조건부 임상 제도를 활성화하기 위해 2016년 ‘획기적 의약품 및 공중보건 위기대응 의약품 개발촉진법안’을 국회 보건복지위원회에 발의했다. 그러나 제도 남용이 우려된다는 일부 반대 목소리에 막혀 2년째 계류 중이다. 비슷한 제도를 운영하는 미국에서는 2015년 한 해에만 40개 제품이 ‘획기적 의약품’으로 지정됐다.
복잡한 약가제도도 신약 개발에 부담이 되고 있다. 식약처 허가를 받은 약이 건강보험 시장에 진입하려면 건강보험심사평가원의 비용 효과성 평가를 통과한 뒤 국민건강보험공단과 약가 협상을 해야 한다. 심평원과 건보공단으로 나뉜 이중 협상 구조 때문에 혁신 신약의 시장 진입 속도가 늦어진다는 지적이 끊이지 않고 있다.
경제협력개발기구(OECD) 평균보다 45% 낮은 국내 약가 구조도 제약산업 발전의 걸림돌로 지적된다. 업계 관계자는 “제약사가 신약 등을 수출하려면 여러 나라 정부와 협상해야 하기 때문에 국내 약가가 중요한 잣대가 된다”며 “위험분담제, 이중약가제도 등 기업에 약가 결정권을 좀 더 부여하는 방식으로 제도를 바꿔야 한다”고 했다.
이지현 기자 bluesky@hankyung.com
-
기사 스크랩
-
공유
-
프린트





![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








