이온 “대웅제약 ‘나보타’ 경추 근긴장이상 美 2상 성공”
내년 3상 진입 계획
미국 이온 바이오파마는 ‘ABP-450’(제품명 나보타)가 경추 근긴장이상 미국 임상 2상에서 1·2차 평가지표를 충족했다고 지난 23일(현지시간) 밝혔다.
이번 임상은 총 20개 연구기관에서 57명의 환자를 대상으로 무작위, 이중 맹검, 위약 대조 방식으로 이뤄졌다. 저용량(150유닛), 중간 용량(250유닛) 및 고용량(350유닛)의 ABP-450 투약군과 위약 투약군까지 총 4개의 환자군(코호트)으로 진행했다.
1차 지표는 치료 관련 중대한 이상 반응 발생률 및 치료 4주차의 토론토 서부 경련성 사경 평가 척도(TWSTRS) 변화였다. TWSTRS는 근긴장도를 측정하는 지수다.
임상 결과, ABP-450 3가지 용량 모두에서 안전성과 내약성이 확인됐다. 유해 사례 발생률이 다른 경추 근긴장이상 치료용 보툴리눔 독소 제품과 비슷하거나 더 낮았다. 유해 사례의 정도는 경증 또는 중등도였다. 일시적이었고 심각한 사례는 없었다. 특히 보툴리눔 톡신 치료를 위해 사용하는 최대용량인 350유닛에서도 심각한 이상반응이 나타나지 않았다는 데 주목했다.
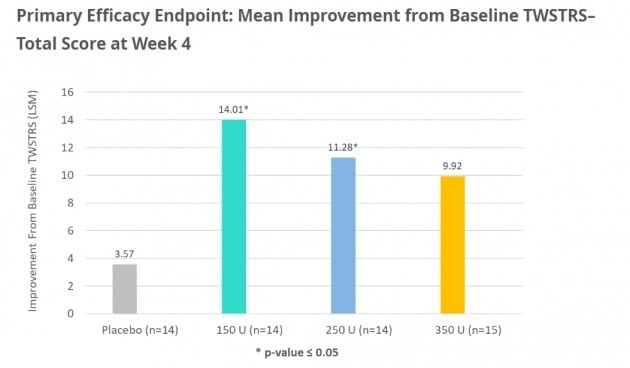
4주차의 TWSTRS 점수 변화도 세 가지 투약군 모두에서 임상적으로 의미 있게 개선됐다는 설명이다.
다만 고용량 투약군의 경우 근소한 차이로 통계적 유의성에 도달하지 못했다. 350유닛의 TWSTRS 점수의 p값이 0.0864로 나타났다. p값은 임상에서 집단 간의 차이가 통계적으로 유의미한지 판단하는 지표다. 보통 0.05 미만이면 성공한 임상이라고 평가한다. 이는 시험군과 대조군 간 차이가 우연이 아닌 약효 등 개입변수로 인해 발생했을 확률이 95% 이상라는 것을 의미한다. 고용량에서는 효과가 적었으나 전반적으로 점수가 의미있게 개선됐다고 회사 측은 강조했다.
저용량과 중간 용량의 p값은 각각 0.007과 0.0406으로 모두 통계적으로 유의한 개선을 보였다. 투약 전과 비교한 TWSTRS 변화 점수는 각각 14.01과 11.28이었다. 위약은 3.57이었다.
경추 근긴장이상은 목 근육이 환자의 의지가 상관없이 수축 또는 이완되는 질환이다. 심해지면 목이 비정상적인 방향으로 휘기도 한다. 처음에는 물리 치료가 권장되고 다음 단계에서는 보툴리눔 톡신 주사가 활용된다. 톡신 주사는 시간이 지나면서 효과가 사라지기 때문에 3~4개월에 한 번씩 주기적으로 맞아야 한다. 그 외 남은 방법은 수술이다. 이온은 현재 미국의 경추 근긴장이상 시장 규모를 약 3억6000만달러(5123억원)로 추산하고 있다.
ABP-450은 ‘클로스트리듐 보툴리눔’이라는 세균이 생산하는 900kDa(킬로달톤)의 보툴리눔 독소 A형을 함유하고 있다. ABP-450은 신경전달 물질의 방출에 관여하는 단백질인 ‘SNAP-25’를 절단해 근육의 신경을 제거하고 이완시키는 기전을 갖고 있다.
이온은 대웅제약으로부터 미국 캐나다 유럽연합 영국 등에서 ABP-450를 치료제로 독점 개발 및 유통할 수 있는 권리를 확보했다. 내년 1분기 FDA와 ABP-450 경추 근긴장이상 2상 종료 회의를 마치고 내년에 3상에 진입한다는 계획이다.
마크 포스 이온 최고경영자(CEO)는 “이번 긍정적인 결과는 ABP-450이 다른 보툴리눔 독소 제품과 동일하거나 이를 능가하는 효능을 갖고 있음을 확인시킨다”며 “편두통 예방 및 위 마비 치료 등 ABP-450의 다른 적응증에 대한 치료 효과에도 확신을 얻었다”고 말했다. 이온은 ABP-450의 또 다른 치료 적응증인 만성 및 삽화성 편두통 임상 2상 결과를 내년 가을께 발표할 수 있을 것으로 보고 있다.
대웅제약 역시 이번 임상에 기대를 걸고 있다. 나보타가 앞서 FDA 및 유럽 의약품청(EMA)으로부터 미간주름 적응증으로 승인을 받은 만큼 치료 적응증도 임상만 성공하면 허가 작업은 순조로울 것이란 예상이다. 이를 통해 국내 제약사 최초로 선진국 톡신 기반 치료제 시장에 진출하겠다는 구상이다.
박성수 대웅제약 부사장은 “미국을 필두로 한 선진국으로의 보툴리눔 톡신 치료 시장 진출은 대웅제약이 오랫동안 준비해 온 대표 미래 성장동력”이라며 “나보타를 환자들에게 합리적인 가격에 공급함으로써 미국의 공익에도 기여할 것으로 기대한다”고 말했다.
이도희 기자 tuxi0123@hankyung.com
-
기사 스크랩
-
공유
-
프린트





![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








