파미셀 간 치료제 '조건부 허가' 무산…또 발목 잡힌 줄기세포치료제 개발
파미셀은 7일 셀그램-엘씨의 조건부 허가가 반려돼 관련 법령에 따라 이의신청할 계획이라고 밝혔다. 조건부 허가는 2상 임상시험 자료를 토대로 우선 허가를 승인해 주고 시판 후 3상 임상시험 자료를 제출토록 하는 제도다. 식약처는 2016년 생물학적 제제 등의 품목허가심사 규정을 개정하고 생명을 위협하는 질환 또는 중증의 비가역 질환에 사용하는 세포치료제는 임상 2상 결과만으로 조건부 허가를 받을 수 있도록 했다.
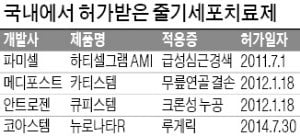
하지만 지난달 29일 열린 중앙약사심의위원회에서는 만장일치로 조건부 허가가 부결됐다. 임상시험 환자들이 조건부 허가 요건에 해당하는 중증 환자가 아니고 생존율 개선을 입증하지 못했다는 점에서다. 파미셀은 “지난 1년여간 식약처 심사관이 임상 3상이 100% 성공할 것이라는 자료를 제출하라는 등 조건부 허가 제도의 입법 취지에 맞지 않고 규정을 벗어난 과도한 자료를 지속적으로 요구했다”고 반박했다. 파미셀은 임상 3상을 진행해 허가를 받는다는 계획이다.
업계는 조건부 허가 대상인 ‘중증 비가역 질환’도 명확히 규정해야 한다고 지적한다. 세포치료제 특성을 고려해 임상 설계부터 조건부 허가까지 기간을 단축할 수 있는 실질적인 지원 방안을 내놓아야 한다는 주장도 나오고 있다.
전예진 기자 ace@hankyung.com
-
기사 스크랩
-
공유
-
프린트


![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








