셀트리온 항체치료제 '3중' 자문 절차로 검증한다
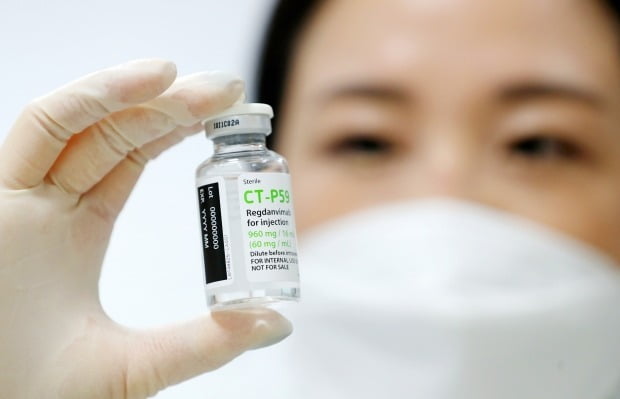
식품의약품안전처는 전문가로부터 렉키로나주의 임상시험 결과를 검증하고 자문하는 '코로나19 치료제 및 백신 안전성·효과성 검증 자문단'(이하 검증 자문단) 회의를 17일 개최할 예정다.
결과는 18일 공개한다.
식약처는 코로나19 치료제 및 백신에 대해 객관적이고 투명하게 허가 심사하고자 외부 전문가에 '3중'으로 자문하는 절차를 마련했다. 자문은 검증 자문단, 중앙약사심의위원회(중앙약심), 최종점검위원회 순으로 이뤄진다.
검증 자문단 회의는 전문가 자문 절차의 가장 첫 단계다. 감염내과 중심의 전문가 30명이 참여한다. 렉키로나주에 대한 검증 자문단 회의에서는 임상시험 결과가 이 약물의 치료 효과를 인정하기에 적절한지 등을 논의한다. 셀트리온은 전날 경증 및 중등증 코로나19 환자에 렉키로나주를 투여한 결과 회복기간을 3일 이상 단축하고, 중증 환자 발생률을 54% 감소시키는 효과를 냈다고 밝혔다.
검증 자문단 회의 이후에는 식약처 자문기구인 중앙약심 자문위원으로부터 의견을 구한다. 중앙약심 자문위원은 생물의약품분과위원회 상임위원 등 15명 내외로 구성된다. 여기서는 검증 자문단에서 논의한 사항, 임상적 유용성 등을 다룬다.
이후 식약처는 10명 안팎의 내·외부 전문가가 공동으로 참여하는 최종점검위원회를 개최해 최종 허가를 정한다. 검증 자문단과 중앙약사심의위원회 자문 결과를 토대로 최종 점검할 예정이다.
안혜원 기자 anhw@hankyung.com
-
기사 스크랩
-
공유
-
프린트



![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








