5월 새로운 바이오 공시가이드라인 시행…달라진 점은
임상정보확인서에 CRO 날인
IND 승인 확인서에 있어야만
하위 및 2차지표 공시 가능해
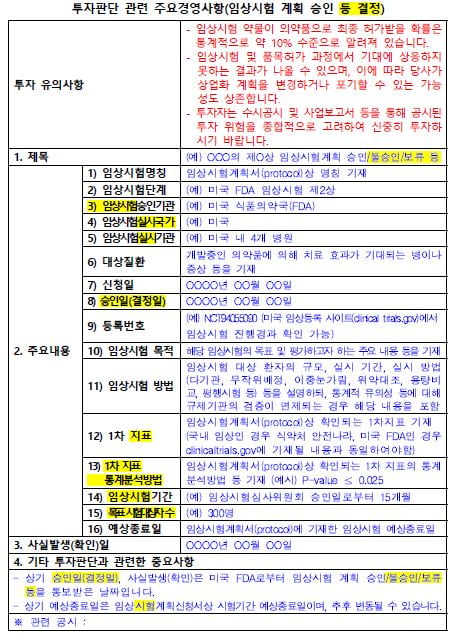
28일 한국거래소 코스닥시장본부에 따르면 내달 2일부터 제약·바이오 업종을 위한 포괄공시 가이드라인을 시행한다. 바이오 공시 가이드라인은 2020년 2월 처음 등장했다. 시행 2년 만인 2022년 2월 임상시험 종료에 대한 기준을 재정비한 지 1년 만에 다시 개정안을 발표했다.
거래소 측은 개정 배경에 대해 “포괄조항 공시는 기타 열거주의 공시와 다르게 표준화된 서식이 없어 공시 문안에 대해 형식적 제약 없이 자유롭게 기재가 가능했다”며 “중요 정보가 누락되거나 주관적, 추상적 표현이 포함돼 투자자 혼란을 초래하는 문제가 있었다”고 설명했다.
임상 관련 공시에 ‘표’ 도입
개정된 가이드라인에는 임상과 관련된 6가지(임상계획승인신청, 임상계획승인, 임상결과, 자진 취하, 변경승인신청, 변경승인) 공시에 대한 표준서식을 도입했다.향후 코스닥 바이오 상장사는 거래소가 만든 ‘표’에 맞춰 공시하게 된다. 표에서 제시하는 1차지표, 1차지표 통계분석방법, 신청일, 승인일, 임상시험실시기관, 임상 등록번호, 시험 참여 환자수, 예상종료일 등을 모두 기재해야 한다.
임상 목적에 따라 1차지표에 대한 하위 분석 또는 2차지표가 중요 정보에 해당할 경우 1차지표와 구분해 ‘기타투자판단과 관련한 중요사항’에 기재한다. 상장사가 임의로 하위지표 중 일부 유리한 정보만 선택적으로 제공할 수 없다. 공시를 원할 경우 모든 하위지표를 기재해야 한다.
임상 관련 공시에서 ‘기대효과’ 부분은 삭제됐다. 앞서 기대효과 부분에 상장사들은 “세계 최초 신약으로서 개발 기대”, “기술수출에 대한 심층적 협의를 진행” 등을 기재해 왔다. 하지만 실제로 기술수출, 품목허가로 이어진 사례는 드물었다. 거래소가 회사의 자의적인 해석이 담긴 내용을 공시하는 것을 원천적으로 차단한 것이다.
확인서에 없는 결과 지표 공시 불가
이번 가이드라인에서 새로 생긴 조항이 있다. ‘임상정보확인서’ 제출의 의무화다. 임상정보확인서는 임상시험계획승인에 대한 공시를 진행함과 동시에 거래소에 비공개 첨부 서류로 제출하게 된다.서류에는 1차지표, 통계분석 방법 등 임상의 주요 정보를 기재한다. 또 “기재한 내용이 사실과 다를 경우 코스닥시장 공시규정 제27조에 따른 불성실법인 지정 등 불이익을 감수할 것이며, 추후 내용이 변경될 시 즉시 정정할 것을 확약한다”는 내용으로 임상시험 의뢰인(상장법인 대표이사) 및 임상수탁기관(CRO 대표이사)의 날인을 받아야 한다.
앞으로 임상정보확인서에 기재되지 않은 주요 내용은 임상시험계획승인 및 임상시험결과 공시에 기재할 수 없다. 공시 문안에 1차지표의 하위분석, 2차지표에 대한 내용 기재를 희망할 경우 임상정보확인서 양식을 수정한 후 상장법인 대표이사 및 CRO 대표이사의 날인을 받아 다시 제출하는 과정을 거쳐야 한다.
김유림 기자 youforest@hankyung.com
**이 기사는 바이오·제약·헬스케어 전문 사이트 <한경 BIO Insight>에 2023년 4월 28일 15시 32분 게재됐습니다.
-
기사 스크랩
-
공유
-
프린트





![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[이 아침의 바이올리니스트] 베를린 슈타츠카펠레 동양인 최초 종신악장](https://timg.hankyung.com/t/560x0/photo/202404/AA.36535699.3.jpg)