FDA, 독감·코로나19 자가진단키트 첫 승인…출시 불투명
국내는 전문가용 동시진단 제품만 승인
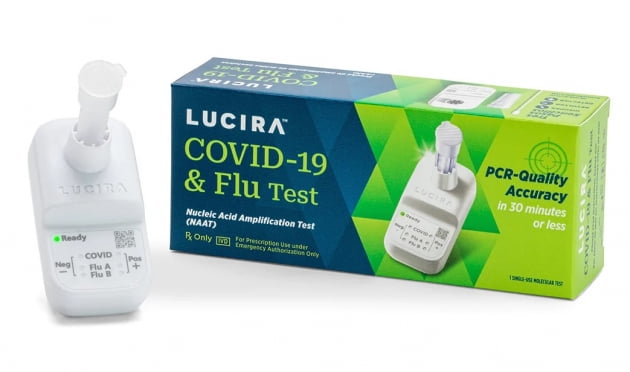
승인 제품은 코로나19 등 호흡기 감염 질환의 증상이 있을 때 사용하는 일회용 자가진단키트다. 면봉을 사용해 비강에서 채취한 검체로 약 30분 안에 결과를 확인할 수 있다. 14세 이상은 스스로, 2세 이상은 성인이 대신 검체를 채취한다.
장비 위에 부착된 용기에 검체를 채취한 면봉을 넣고 휘저으면 30분 이내에 A형 독감, B형 독감, 코로나19 각각에 대한 양성 여부가 표시된다. 루시라 제품은 긴급사용승인을 위한 임상에서 유증상자에 대해 코로나19 음성 100% 및 양성 88.3%, A형 독감 음성 99.3% 및 양성 90.1%를 정확하게 식별했다.
B형 독감 음성에 대해서는 99.9%를 정확하게 진단했다. 다만 임상에서 B형 독감 양성 사례가 적어 양성률을 판단하지 못했다. 이에 따라 인위적으로 만든 검체를 통해 B형 독감 양성을 식별할 수 있음을 확인했다. FDA는 실제 환경에서의 B형독감 검출 능력을 계속 검증할 것을 요구했다.
코로나19와 독감을 동시에 진단하는 자가진단키트는 국내에서 승인된 제품이 아직 없다. 전문가용 동시진단 항원 검사키트는 지난 17일 기준으로 12개의 제품이 허가받았다.
업계에 따르면 승인받은 전문가용 동시진단 제품들은 대부분 코로나19와 독감에 대한 각각의 키트를 붙이거나 묶음 포장한 ‘듀오(DUO)’ 방식이다. 젠바디 피씨엘 수젠텍이 하나의 키트로 독감과 코로나19에 대한 진단을 동시에 수행하는 ‘콤비(COMBI)’ 방식의 제품을 승인받았다.
개발사 파산신청…출시 여부 불투명
FDA의 품목허가 발표 후 루시라헬스 주가는 13.45% 급등했다. 하지만 뉴욕타임즈는 루시라헬스가 FDA 발표 이틀 전에 파산을 신청했기 때문에, 소비자에게 공급될지는 불투명하다고 보도했다.루시라헬스는 코로나19 진단 수요가 급증하며 지난 몇년 간 급속도로 성장했다. 하지만 지난해 코로나19 진단에 대한 수요가 감소하면서, 이달 22일 미국 파산법 353조에 따라 사업 매각을 추진한다고 발표했다.
루시라헬스는 “코로나19 및 독감 동시진단 가정용 제품에 대한 품목허가를 지난해 8월 예상했지만 승인 절차가 길어지며 새로운 수익이 발생하지 않았다”며 파산신청의 배경을 설명했다.
박인혁 기자 hyuk@hankyung.com
**이 기사는 바이오·제약·헬스케어 전문 사이트 <한경 BIO Insight>에 2023년 2월 27일 9시 28분 게재됐습니다.
-
기사 스크랩
-
공유
-
프린트



![월가 "인텔 망가졌다"…구글 9년 만에 최고의 날 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240427071917087.jpg)








