내년 43조원 시장 열리는 바이오시밀러...삼바·셀트리온 전략은?
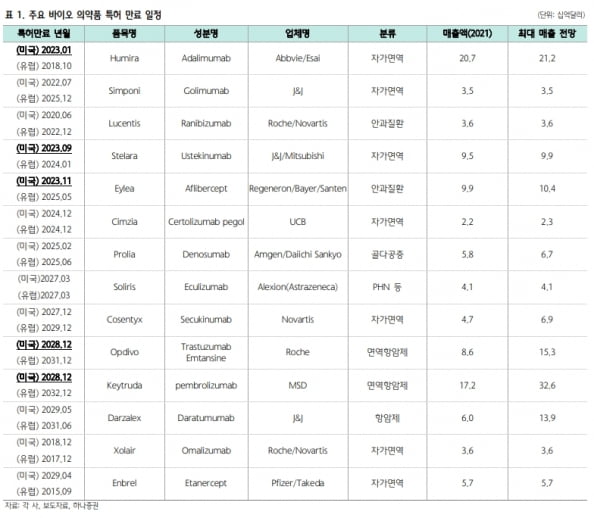
28일 업계에 따르면 내년 1월 암젠의 휴미라 바이오시밀러가 미국에서 첫 출시된다. 휴미라는 류머티즘 관절염, 궤양성 대장염 등을 적응증으로 하는 애브비의 자가면역질환 치료제다. 지난해 207억달러(약 27조7000억원)의 매출을 기록했다. 의약품 중 세계 1위 매출이다. 이 중 미국 매출이 177억달러로 대부분을 차지했다.
오리지널 의약품은 바이오시밀러의 침투를 방어하기 위해 물질특허, 조성물 특허, 제형 특허 등 다수의 특허를 구축하고 있다. 휴미라의 미국 물질특허는 2016년 이미 만료됐다. 하지만 남아있는 특허들에 대해선 애브비와 바이오시밀러 개발사가 합의를 진행할 수 있다. 합의를 통해 시기 등을 조정해 경상기술사용료(로열티)를 지불하고 바이오시밀러를 시장에 출시할 수 있다는 게 업계 관계자의 설명이다.
내년 9월과 11월부턴 자가면역질환 치료제 ‘스텔라라’와 황반변성 치료제 ‘아일리아’의 바이오시밀러 출시도 가능해진다. 이들 역시 2021년 각각 95억달러와 99억달러의 매출을 낸 블록버스터 의약품이다.
업계에선 2023년 오리지널 바이오의약품의 특허 만료로 332억달러(약 42조6200억원)의 시장이 새롭게 형성될 것으로 보고 있다. 박재경 하나증권 연구원은 “2013년 바이오시밀러 시장이 개화한 이후 가장 큰 규모”라고 말했다.
10개 휴미라 바이오시밀러 美 출시

삼성바이오에피스는 2019년 7월 저농도 휴미라 바이오시밀러에 대해 미국 식품의약국(FDA)의 허가를 획득했다. 이후 올해 8월 고농도 휴미라 바이오시밀러의 허가도 승인받았다.
셀트리온은 고농도 휴미라 바이오시밀러 ‘유플라이마’의 연내 FDA 승인을 예상하고 있다. 애브비와 미국 특허에 합의해 내년 11월이었던 유플라이마의 출시 일정을 7월1일로 앞당겼다.
베링거인겔하임의 ‘실테조’, 알보텍의 ‘AVT02’, 코헤러스의 ‘유심리’, 비아트리스의 ‘훌리오’, 산도스의 ‘하이리모즈’, 화이자의 ‘아브릴라다’, 프레제니우스 카비의 ‘이다시오’ 등도 내년 7월 이후 연이어 휴미라 바이오시밀러를 미국 시장에 출시할 예정이다.
휴미라 바이오시밀러 시장의 경쟁이 치열해지면서 원가 절감을 통한 가격 경쟁력과 차별화 전략이 더욱 필요해지고 있다는 판단이다. 대표적인 차별화 전략은 ‘제형 변경’이다.
휴미라는 구연산(citrate)을 완충액으로 사용하지 않는다. 구연산은 유효 성분의 산도를 유지해 단백질을 안정화하는 역할을 하지만, 주사 시 통증(ISR)을 일으키기 때문이다. 또 투여 부피를 줄이기 위해 저농도(50mg/mL)에서 고농도(100mg/mL)로 높이고, 주사 바늘의 굵기를 27게이지에서 29게이지로 바꿔 제형에 차별화를 뒀다.
삼성바이오에피스와 셀트리온도 고농도로 출시해 경쟁력을 확보할 계획이다. 하드리마와 유플라이마도 고농도, 구연산 완충액 미포함(citrate free) 제형으로 개발되고 있다.
유현수 유안타증권 연구원은 “미국 휴미라 바이오 시밀러 시장 경쟁에서 고농도 제형을 확보하고 있는지가 경쟁력을 결정할 것”며 “고농도 휴미라는 미국 휴미라 시장의 대부분인 85%를 차지하고 있고, 투여 볼륨을 줄여 투약시 낮은 통증으로 선호되면서 고농도 투약 환자가 저농도로 전환하는 비율은 제한적일 것”으로 판단했다.
고농도의 휴미라 바이오시밀러로는 현재까지 삼성바이오에피스만이 FDA 승인을 획득했다. 셀트리온 암젠 알보텍은 고농도 제형에 대한 승인을 진행하고 있다.
이지수 다올투자증권 연구원은 “이중 알보텍은 지난 9월 생산시설 결함으로 FDA로부터 보완요구서한(CRL)을 받으면서 출시 시점이 불투명해졌다”며 “이에 따라 삼성바이오에피스와 셀트리온이 고농도 시장에서 빠른 시장점유율(MS) 확보가 가능할 것”으로 전망했다.
“바이오시밀러 시장, 갈수록 경쟁 심화할 것”
휴미라 외에도 순차적으로 바이오 의약품 특허 만료가 이어질 예정이다. 올 하반기엔 스텔라라와 아일리아 바이오시밀러의 미국 출시도 가능해진다.국내에선 삼성바이오에피스 셀트리온과 함께 동아에스티가 스텔라라 바이오시밀러를 개발하고 있다. 동아에스티는 ‘DMB-3115’의 글로벌 임상 3상을 마쳤다. 임상은 중등도~중증 만성 판상 건선 환자를 대상으로 DMB-3115와 스텔라라 피하주사(SC)의 유효성, 안전성, 면역원성을 비교했다. 3상 결과를 분석해 긍정적인 데이터가 나오면 2023년 상반기 미국과 유럽에 DMB-3115의 품목허가를 신청할 계획이다.
아일리아 바이오시밀러를 개발하고 있는 국내 기업은 삼성바이오에피스 삼천당제약 알테오젠 셀트리온 로피바이오 등 5곳이다. 삼천당제약은 아일리아 바이오시밀러 ‘SCD411’를 개발하고 있다. 최근 글로벌 3상을 마치고, 내년 1월 최종보고서를 받을 예정이다. 일본에서 가장 먼저 허가를 받고, 미국 한국 유럽에서 순차적으로 허가를 신청할 예정이다.
내년 이후에도 블록버스터 항체 약물의 바이오시밀러 출시가 줄줄이 가능해지면서 경쟁은 갈수록 심화될 전망이다. 2024년에는 자가면역질환 치료제 ‘심지아’. 2025년에는 발작성야간혈색소뇨증(PNH) 치료제 ‘솔리리스’와 골흡수억제제 ‘프롤리아’, 천식·두드러기 치료제 ‘졸레어’ 등의 미국 특허가 만료된다.
삼성바이오에피스는 프롤리아 바이오시밀러의 3상을 진행 중이며 솔리리스 시밀러의 경우 허가 신청 상태다. 셀트리온도 프롤리아와 졸레어 바이오시밀러의 글로벌 3상을 진행 중이다. 이수앱지스도 솔리리스 시밀러 ‘ISU305’를 개발하고 있다.
2028년부터는 거대 블록버스터 면역항암제들의 특허 만료가 이어진다. 지난해 기준 172억달러의 매출을 기록한 ‘키트루다’와 83억달러의 매출을 낸 ‘옵디보’는 2028년 말 특허가 만료될 예정이다.
-
기사 스크랩
-
공유
-
프린트




![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[오늘의 arte] 티켓 이벤트 : 윤한결의 한경아르떼필과 브람스 교향곡](https://timg.hankyung.com/t/560x0/photo/202404/AA.36536873.3.jpg)