약 하나로 두 가지 치료효과…제약社 '이중항체'에 꽂혔다
서로 다른 두개의 항원 결합
암세포 죽이면서 면역력 강화
J&J 등 차세대 먹거리로 눈독
국내선 에이비엘바이오 '눈길'
최근 글로벌 제약업계에 ‘이중항체 붐’이 일고 있습니다. 차세대 항암 기술로 주목받기 시작하면서죠. 지난달 25일 존슨앤드존슨(J&J)은 미국 식품의약국(FDA)으로부터 이중항체 기반의 다발성 골수종 치료제 ‘텍베일리’에 대한 가속승인을 받았습니다. 다발성 골수종은 플라즈마 B세포가 비정상적으로 많아지면서 생기는 혈액암의 일종입니다. 이중항체인 텍베일리는 B세포 성숙항원(BCMA)과 T세포를 활성화하는 CD3 분자에 동시 작용합니다. 미국에서 다발골수종 치료제로 허가받은 첫 번째 이중항체 신약입니다.
개발 중인 이중항체 기반 후보물질의 임상 결과도 긍정적으로 나오면서 글로벌 제약·바이오 기업의 이중항체 시장에 대한 관심이 높아지고 있습니다. 이중항체 기술을 일단 확보하고 나면 다양한 질병에 적용할 수 있어 사업 확장성도 크다는 평가를 받습니다. 국내 이중항체 선두주자는 설립 7년 차인 에이비엘바이오입니다. 세계 6위 제약사 프랑스 사노피에 이중항체 후보물질 ‘ABL301’을 조(兆) 단위에 기술수출하면서 세계적 관심을 받았습니다. ABL301은 파킨슨병 원인 단백질을 차단함과 동시에 약물의 뇌혈관장벽(BBB) 침투를 높여주는 파킨슨병 치료제입니다.
한국바이오협회에 따르면 세계적으로 개발 중인 이중항체 후보물질은 600여 개에 달합니다. FDA, 유럽의약품청(EMA) 승인을 받은 이중항체 의약품은 6개에 불과합니다. 두 곳에서 모두 승인받은 약물은 2개뿐입니다. 시장이 초기 단계인 셈이죠. 그만큼 넘어야 할 기술장벽이 높다는 뜻이기도 합니다. 이상훈 에이비엘바이오 대표는 “독성을 최소화하고 어떻게 기존 내성을 극복하느냐가 핵심”이라고 했습니다.
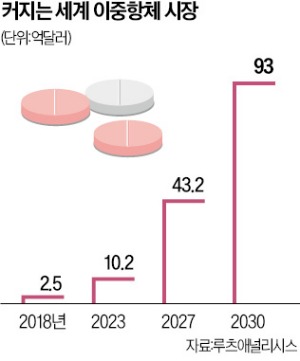
이중항체 시장 전망은 밝습니다. 시장조사기관 루츠애널리시스는 세계 이중항체 시장이 2018년 2억5000만달러(약 3600억원)에서 2030년 93억달러(약 13조원)로 급성장할 것으로 보고 있습니다.
남정민 기자 peux@hankyung.com
-
기사 스크랩
-
공유
-
프린트





![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








