“브릿지바이오, 임상 발표 이어갈 것…기업가치 상승 기대”
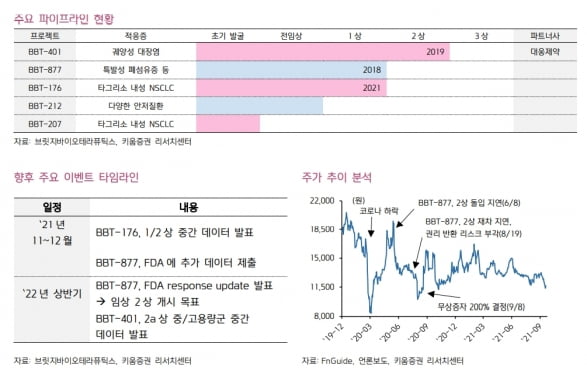
브릿지바이오테라퓨틱스는 올해 ‘C797S’ 돌연변이 표적 ‘BBT-176’의 1·2상 중간 데이터 발표를 시작으로, 내년 상반기 ‘BBT-877’의 2상을 개시하고 ‘BBT-401’의 2a상 중·고용량군 중간 데이터를 발표할 예정이다.
허혜민 연구원은 “회사는 작년 4월 이후 임상 데이터 발표 부재로 주가가 지속적으로 하락했다”며 “올해부터 내년까지 임상 데이터 발표에 따른 동력(모멘텀)을 이어갈 것”이라고 판단했다.
BBT-176은 4세대 비소세포폐암(NSCLC) 치료제다. 경쟁 후보물질인 블루프린트의 ‘BLU-945’은 국내와 미국에서 1상을 진행 중이다. 브릿지바이오테라퓨틱스의 개발 단계가 6개월 가량 앞섰다는 설명이다.
허 연구원은 “중국 바이오텍 EQRx의 발표에서 C797S 돌연변이 발현율은 3차 치료 이후 최대 26%로, 기존 타그리소 데이터의 7~22%보다 증가했다”며 “이 데이터는 브릿지바이오테라퓨틱스 후보물질(파이프라인)의 가치를 부각시킬 수 있다”고 말했다.
시장 확대는 향후 협력 계약 체결에도 긍정적인 영향을 줄 것이란 판단이다. 2032년 NSCLC 시장은 570억달러 규모로 전망된다. 이 중 약 35%가 관찰되는 ‘EGFR’ 돌연변이 시장은 190억2500만달러 규모다. EQRx 발표에 따라 C797S 돌연변이 발현율을 최대 26%라고 가정하면, C797S 돌연변이 표적 시장 규모는 50억달러에 달한다는 설명이다.
허 연구원은 “경쟁 파이프라인이 한 개임을 감안하면, BBT-176은 2032년 최대 20억5000만달러의 매출을 낼 것”이라고 전망했다.
오토택신 저해제 BBT-877은 내년 상반기 2상을 개시할 예정이다. 2019년 7월 베링거인겔하임에 11억유로 규모로 기술이전됐지만, 작년 11월 잠재적 독성 우려로 기술을 반환받았다.
브릿지바이오테라퓨틱스는 생화학적 분석 기법으로 혜성 분석을 진행한 결과 별다른 독성 이슈가 없어, 미국 식품의약국(FDA)에 데이터를 제출했다. FDA로부터 추가 자료를 요구받아 연내 제출할 계획이다. 내년 1분기 2상을 개시한다는 목표다.
허 연구원은 “현재 글로벌 오토택신 저해제 파이프라인 중 개발 단계가 가장 빠른 상황”이라고 설명했다.
이와 함께 내년 상반기에 ‘펠리노-1’ 저해제 BBT-401의 2a상 중·고용량군 환자에 대한 중간 데이터도 발표한다. BBT-401은 현재 2a상 중·고용량군 환자 10명을 대상으로 투약을 진행 중이다.
허 연구원은 “BBT-401은 먹는 약(경구용)이면서 환부에 특정적으로 작용하는 치료제로는 세계에서 유일하다”며 “1상에서 안전성, 2a상 저용량군에서 효능을 입증해 중·고용량군 데이터에 따라 기술이전 가능성도 높아질 것”이라고 했다.
이어 “연내 중국 1상이 개시되면 아시아 22개국 판권을 갖고 있는 대웅제약으로부터 단계별기술료(마일스톤) 수취도 가능하다”고 말했다.
현재 발굴 중인 후속 파이프라인 ‘BBT-207’도 2023년 글로벌 임상을 개시할 것으로 기대했다. BBT-207은 4세대 NSCLC 치료제로, BBT-176과 함께 기술이전도 가능할 것이란 예상이다.
-
기사 스크랩
-
공유
-
프린트




![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








