“알테오젠 피하주사 변경 기술, 키트루다SC 임상 사용 추정”
지난 23일(현지시간) 미국 임상정보포털(클리니컬트라이얼즈)에는 MSD의 키트루다SC 임상 1상 정보가 등록됐다. 임상명은 ‘진행성 고형 종양(MK-3475A-C18)에서 MK-3475A(MK-5180로 제형화된 펨브롤리주맙)의 피하(SC) 주사를 통한 펨브롤리주맙(MK-3475)의 생체이용률 평가 연구’다.
이번 1상에는 히알루론산분해효소(hyaluronidase)에 대한 면역반응이 있는 환자는 피험자에서 제외됐다. 또 펨브롤리주맙(키트루다)에 MK-5180 제형을 추가했다는 내용으로 ‘MK-3475A’라는 새로운 명칭이 부여됐다.
엄민용 연구원은 “히알루론산분해효소가 언급됨에 따라, SC제형 변경 기술이 사용됐다는 것을 유추할 수 있다”고 말했다.
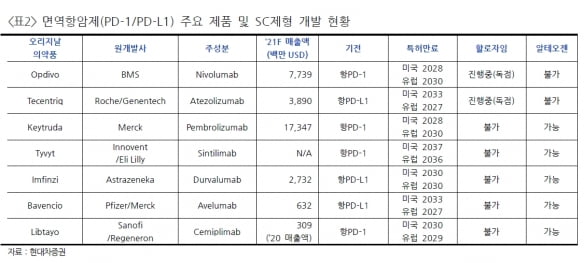
키트루다는 BMS의 옵디보와 동일한 'PD-1' 계열의 항암제다. 작년 기준 143억8000만달러(약 15조8000억원)의 매출을 냈다.
엄 연구원은 “옵디보는 미국 할로자임의 ‘ENHANZE’ 기술을 통해 2017년부터 SC제형을 개발 중이며, PD-1 기전의 독점적 권리를 갖고 있다”며 “이에 동일 기전의 키트루다가 SC제형 변경을 위해서는 선택지가 알테오젠의 ALT-B4밖에 남지 않은 상황”이라고 설명했다.
지난달 9일 추가 게재(업데이트)된 키트루다SC 임상 3상은 비소세포폐암 환자 450명을 대상으로 하며, 투약 주기가 3주 간격이다. 소아용 또는 저용량 200mg으로 추정했다.
엄 연구원은 “현재 옵디보는 6주 간격 투약이기 때문에, 키트루다SC 저용량 200mg는 3주 간격 투약으로 개발 시 경쟁력이 없다”며 “고용량 400mg 6주 간격 투약의 SC제형변경 만이 경쟁력을 가진다”고 판단했다.
이어 “키트루다 400mg 고용량 제형은 임상 1상에서 생물학적 동등성을 입증하고, 향후 임상 3상에서 정맥(IV)주사 제형과의 비열등성을 입증하기 위해 히알루로니다제를 통한 SC제형 변경 기술이 필요하다”고 했다.
그는 MSD가 자체적으로 진행 중인 키트루다 임상 1·3상 자료는 히알로루니다제를 통한 SC제형변경의 임상 1상을 마무리한 후, 빠른 임상 3상 전환을 위한 자료로 활용될 것으로 봤다.
-
기사 스크랩
-
공유
-
프린트


![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[신간] 나무 내음을 맡는 열세 가지 방법](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36534703.3.jpg)