안트로젠 “당뇨병성족부궤양 美 2상서 긍정적 경향 확인”
현재 미국에서는 당뇨병성족부궤양 치료제로 인체양막제제인 오시리스의 그라픽스(Grafix)가 가장 높은 시장점유율을 차지하고 있다. 그라픽스는 최소조작의약품으로 미국 식품의약국(FDA)의 의약품 허가를 받지 않았다.
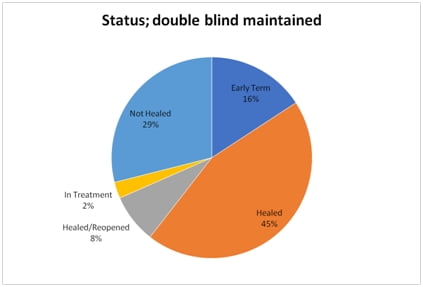
안트로젠의 ALLO-ASC-SHEET는 2상에서 현재까지 전체 환자 중 45%에서 상처완전봉합 및 유지 효능을 입증했다. 8%에서는 상처완전봉합 후 재발(관찰기간 동안)을 확인했다. 총 53%의 환자에서 12주 내 상처완전봉합이 관찰됐다는 설명이다. 완전봉합이 이뤄지지 않은 환자수와 중도탈락한 환자가 45%를 차지했고, 현재 치료중인 환자는 2%다.
이번 2상은 시험군과 대조군이 1대 1 비율로 무작위 배정돼 이뤄지고 있다.
회사 관계자는 “ALLO-ASC-SHEET는 45%의 상처완전봉합 및 유지가 100% 시험군에서 일어났다고 가정하면, 시험군의 완전치료율은 90%”라며 “45%의 상처완전봉합 및 유지가 80% 시험군에서 일어나면 완전치료율은 72%가 될 것”이라고 설명했다.
그라픽스는 2014년 발표한 임상에서 전체 환자의 42%에서 상처완전봉합률을 기록했다. 현재 이 임상은 독립적위원회(IMC) 권고로 조기 중단된 상태다.
안트로젠은 임상 2상을 마친 후, 임상시험계획서 제출 전 사전회의(pre-IND meeting)를 통해 임상 3상에 진입할 계획이다. 당뇨병성족부궤양 임상의 유효성 평가지표(primary end point)는 ‘완전상처봉합’이다. 유효성 측면에서 매우 명확한 결과를 예상한다고 회사 측은 전했다.
회사는 현재까지 당뇨병성족부궤양 치료제로 FDA의 정식 허가를 받은 의약품은 없다고 했다. 이에 ALLO-ASC-SHEET가 허가를 받으면, FDA 허가를 받은 최초의 의약품이 될 것으로 기대하고 있다.
안트로젠 관계자는 “ALLO-ASC-SHEET 임상에서 좋은 결과를 도출해 낼 것으로 기대하고 있다”며 “현재 진행 중인 미국 임상 2상과 나머지 3상을 통해 대한민국의 신약이 미국에 진출하는 쾌거를 이루기 위해 최선을 다할 것”이라고 말했다.
김예나 기자 yena@hankyung.com
-
기사 스크랩
-
공유
-
프린트





![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[신간] 나무 내음을 맡는 열세 가지 방법](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36534703.3.jpg)