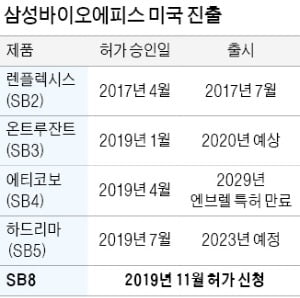
삼성바이오에피스, 대장암·폐암 복제약 'SB8' 美 허가 신청

삼성바이오에피스는 20일 아바스틴(성분명 베바시주맙) 바이오시밀러인 SB8에 대한 FDA의 서류심사가 시작됐다고 밝혔다. 서류심사 착수는 삼성바이오에피스가 지난 9월 제출한 신청서의 사전 검토를 마치고 실질적인 허가 과정에 들어갔다는 것을 의미한다.
아바스틴은 전이성 대장암, 비소세포폐암 등에 사용되는 항암제로 스위스 로슈가 판매하고 있다. 지난해 매출은 68억4900만스위스프랑(약 8조2000억원)이었다. 미국 시장 비중은 42%에 이른다.
삼성바이오에피스는 국제학회에서 SB8의 임상 결과를 알리고 있다. 9월 스페인 바르셀로나에서 열린 유럽종양학회에서 처음 공개한 임상 3상 결과에 따르면 비소세포폐암 환자 763명을 대상으로 한 임상에서 오리지널 의약품 대비 환자 리스크 반응 비율의 동등성이 입증됐다.
삼성바이오에피스는 류머티즘관절염 등 자가면역질환 치료 바이오시밀러인 렌플렉시스(레미케이드)를 미국에서 판매 중이다. 에티코보(엔브렐), 하드리마(휴미라) 등 자가면역질환 치료 바이오시밀러 2종과 항암 바이오시밀러인 온트루잔트(허셉틴)는 FDA의 판매 허가를 받았다.
삼성바이오에피스는 글로벌 바이오시밀러 시장 공략을 위해 마케팅 파트너십을 강화하고 제품군 확대를 위한 연구개발(R&D)을 하고 있다. 희귀질환 치료제 SB12(솔리리스 바이오시밀러)와 안과질환 치료제 SB11(루센티스 바이오시밀러)은 임상 3상을 하고 있다. 안과질환 치료제 SB15(아일리아 바이오시밀러)는 임상 3상을 준비 중이다.
박상익 기자 dirn@hankyung.com
-
기사 스크랩
-
공유
-
프린트


![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








