"SK, 신약개발 임상·허가·판매까지 독자적 수행"
20년 제약바이오 정공법 투자
올들어 본격적으로 결실
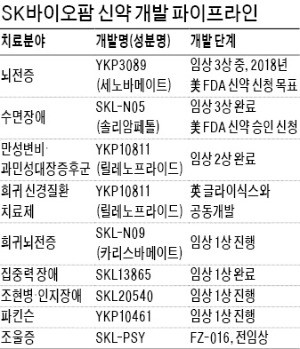
수면장애치료제 미국 허가신청
뇌전증치료제 임상3상 매듭

◆신약 개발부터 판매까지
조정우 SK바이오팜 대표는 최근 경기 성남시 판교 본사에서 만나 “SK그룹은 글로벌 제약사가 되기 위한 ‘풀 밸류체인(가치사슬)’을 완성했다”며 ”올해 임상부터 허가, 판매까지 신약 개발의 모든 것을 보여줄 것”이라고 말했다.
조 대표는 “한국에서는 임상 단계에서 다국적 제약사에 개발 권리를 파는 기술수출을 대단한 성과로 생각하는데 임상부터 최종 허가까지 경험이 중요하다”며 “실패도 많이 하고 시간이 오래 걸렸지만 정공법으로 승부한 덕분에 FDA의 신뢰를 얻을 수 있었다”고 말했다.
◆내년부터 신약 본격 판매

조 대표는 “세계 7조원 규모인 뇌전증 치료제 시장에서 세노바메이트가 성공한다면 그 수익을 바탕으로 신약 개발에 재투자하는 선순환 구조를 완성할 수 있을 것”이라고 기대했다.
내년부터는 수면장애 치료제 ‘SKL-N05’의 미국 시판으로 인한 로열티로 수익성도 개선될 전망이다. SKL-N05는 우울증 치료제로 개발돼 1999년 에어리얼에 기술수출했다가 실패한 뒤 되돌아온 프로젝트다. SK바이오팜은 실패한 임상 데이터를 분석해 잠에서 깨는 각성 효과를 발견하고 갑작스럽게 졸음이 오는 기면증 환자를 위한 치료제를 미국 제약사 재즈와 공동 개발했다. 세계 수면장애 치료제 시장은 연간 1조원 규모다. SK바이오팜은 미국 판권을 보유한 재즈에서 로열티를 받고 일본 중국 등 아시아 12개국에서는 직접 제품을 판매할 계획이다. 조 대표는 “미국은 올해 말 시판 허가를 받고 내년 출시할 예정”이라며 “아시아 지역 판매와 생산은 SK바이오팜과 계열사인 바이오텍이 직접 할 것”이라고 말했다.
◆“항암제 기술도입 검토”
SK바이오팜은 중추신경계 질환의 강점을 살려 영유아 희귀 뇌전증 치료제인 카리스바메이트의 미국 임상 2상을 하고 조현병 치료제의 한국 임상을 시작한다. 조 대표는 기술도입 계획도 밝혔다. 그는 “항암제 분야에서는 자체 개발보다 기술도입을 적극 검토하고 있다”며 “국내 중소 제약사나 삼성, LG 등 대기업과도 협업하고 싶다”고 했다.
조 대표는 올해 기업공개(IPO) 계획과 관련해선 “검토한 적이 없다”고 밝혔다. 그는 “인수합병(M&A)이나 R&D 등을 위한 자금 조달 문제가 시급하지 않기 때문에 당장 상장해야 할 상황은 아니다”며 “SK실트론 SK바이오텍 등 그룹 내 비상장사가 많아 상장 시기는 지켜봐야 할 것”이라고 말했다.
전예진 기자 ace@hankyung.com
-
기사 스크랩
-
공유
-
프린트





![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








