퓨쳐켐, 전립선암 치료제 국내 1상서 유효성·안정성 확인
용량제한독성 관찰되지 않아
거세저항성 전이 전립선암 치료제 FC705는 치료용 동위원소인 'Lu-177'을 사용한다. 전립선암에만 특이적으로 발현되는 'PSMA' 단백질을 표적하는 방사선 리간드 치료제다. 1차 호르몬 치료와 2차 항암 치료 후 재발 및 전이된 환자를 대상으로 개발 중이다.
이번 1상은 퓨쳐켐이 개발 중인 전립선암 진단제 'FC303'을 통해 양성 소견으로 확인된 거세저항성 전립선암 환자 30명을 대상으로 진행됐다. 서울 성모병원에서 1상을 마쳤고, 최종 결과보고서(CSR)를 임상수탁기관(CRO)으로부터 수령했다.
1상은 50mCi(밀리퀴리)부터 150mCi까지 순차적으로 투여용량을 증가시키는 용량 증가(dose-escalation) 방식으로 진행됐다. 총 5개군, 군당 최대 6명에게 정해진 용량을 투여한 뒤 가장 적절한 안정성과 치료효과를 갖는 용량을 도출하기 위한 목적으로 설계됐다.
1차 목표는 용량별 용량제한독성(DLT)을 평가하고, 이를 바탕으로 임상 2상에 적절한 용량을 도출하는 것이다. 2차적으로는 안전성, 치료 후 전립선특이항원(PSA) 수치 평가 및 ORR(객관적반응률)과 DCR(질병통제율)을 평가했다.
FC705를 투여받은 29명을 대상으로 안전성 평가를 실시한 결과, 최대 투여 용량인 150mCi를 포함한 모든 용량군에서 DLT는 관찰되지 않았다. 최대허용용량(MTD)은 확인하지 못했다. 150mCi 투여군에서 1건의 중대이상반응(SAE)이 보고됐으나, 의약품과 관계없는 것으로 확인됐다. 150mCi까지 사람에게 투여함에 있어 문제가 없음을 입증했다는 설명이다.
50~150mCi 투여군을 모두 포함한 분석군(A)과 실제 유효 용량인 100mCi 이상의 투여군(100~150mCi)만 포함한 분석군(B)에 대해 ORR 및 DCR 등을 평가했다. 2상에서 투여 예정인 100mci의 유효성 지표인 종양섭취계수 등에 대한 분석 결과도 나왔다.
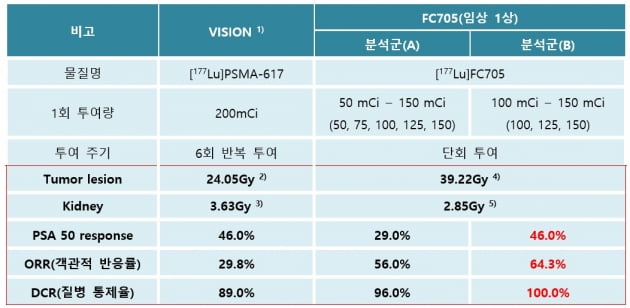
VISION은 노바티스의 방사성 전립선암 치료제 플루빅토(PSMA-617)의 임상 3상 과제명이다. PSA 50 반응률은 PSA가 절반 이상 줄어든 환자의 비율이다.
이 관계자는 "유효 용량 분석군에서는 DCR이 100%로 확인됐다"며 "또 1회 투여 시 전립선암으로의 흡수율도 FC705가 절반 용량임에도 1.63배 높게 나와, 추후 진행될 임상 2·3상에서 도출될 데이터와 글로벌 빅파마와의 협상 기대도 크다"고 했다.
FC705 임상 1상의 결과는 논문으로 작성돼 국제학술지에 게재될 예정이라고 했다. 국내외 학회 발표도 준비 중이다.
한민수 기자 hms@hankyung.com
-
기사 스크랩
-
공유
-
프린트



![월가 "인텔 망가졌다"…구글 9년 만에 최고의 날 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240427071917087.jpg)








