희귀질환 수포성표피박리증 치료제, 韓 바이오텍 선점 기대
31일 업계에 따르면 미국 식품의약국(FDA)는 이달 미국 제약사인 BERG의 수포성표피박리증 치료제 후보물질 'BPM31510'을 희귀의약품으로 지정한 데 이어, 미국 크리스탈바이오텍의 'KB103'을 신속심사 대상으로 지정했다. 이들은 각각 임상 1상 단계다.
국내 바이오벤처인 지트리비앤티와 안트로젠의 개발 속도는 더 빠르다. 각각 미국과 일본에서 희귀의약품으로 지정됐고, 임상 2상을 마쳤다. 지트리비앤티는 연내 수포성표피박리증 치료제 개발을 주도할 자회사를 설립하고 미국 임상 3상에 들어간다는 계획이다.
안트로젠은 2015년 일본 이신제약과 기술수출 계약을 체결했다. 이신제약은 현재 일본 임상 2상을 마치고, 연내 조건부 판매허가를 신청할 예정이다. 허가를 받게 되면 세계 최초의 수포성표피박리증 치료제가 된다. 안트로젠이 치료제를 만들어 이신제약에 공급하기 때문에 허가 시 매출 증가가 전망된다.
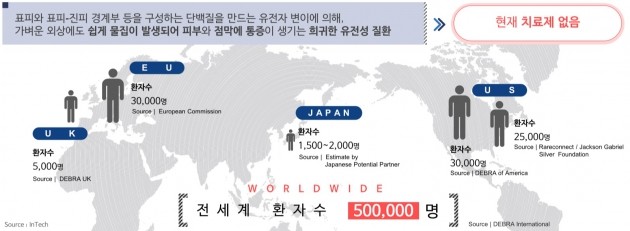
수포성표피박리증은 미국에서 소아 2만명당 1명 정도의 비율로 발생하는 유전성 희귀질환이다. 바깥 쪽 피부(표피)와 안쪽 피부(진피) 사이의 결합 단백질 이상으로 작은 마찰에도 표피가 벗겨진다. 극심한 고통으로 인해 환자 대부분이 10세 이전에 사망하지만, 세계적으로 허가받은 치료제가 없는 상황이다.
피부에 나타나는 증상 치료에만 연간 3만달러(약 3200만원)가 넘는 비용이 든다. 미국과 유럽에서 각각 3만명, 일본 2000명 등 세계 환자수는 50만명으로 추정되고 있다. 2015년 임상 3상 단계의 물질을 8억4700만달러(9100억원)에 인수한 미국 아미쿠스 테라퓨틱스는 수포성표피박리증 치료제 시장 규모를 1조원으로 추산한다. 이 물질의 임상 3상은 효능을 입증하지 못해 실패했다.
제일 강력한 경쟁자는 영국의 엠릿파마다. 엠릿은 미국과 유럽, 호주 등에서 다국가 임상 3상을 준비 중이다. 현재 미국과 유럽 허가당국과 임상 3상 계획의 변경을 논의하고 있다. 아미쿠스의 임상 3상 설계를 검토한 이후, 자신들의 3상 계획을 개선할 방침이다.
한민수 기자 hms@hankyung.com
-
기사 스크랩
-
공유
-
프린트




![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[오늘의 arte] 티켓 이벤트 : 윤한결의 한경아르떼필과 브람스 교향곡](https://timg.hankyung.com/t/560x0/photo/202404/AA.36536873.3.jpg)