유해 단백질 분해 돕는 새로운 단백질 기능 규명
한·미 공동연구팀이 해로운 단백질의 분해를 활성화하는 새로운 기전을 밝혔다.
한국생명공학연구원 김보연 박사팀과 서울대 권용태 교수팀, 미국 피츠버그대 시앙 췬 시에(Xiang-Qun Xie) 교수팀은 세포 내 쓰레기 단백질의 분해 과정을 촉진하는 'p62' 단백질의 기능을 새로 규명했다고 7일 밝혔다.

세포 내 단백질의 수명이 다하면 '유비퀴틴'이라는 작은 단백질이 붙어있는 단백질만 선택적으로 분해하는 '유비퀴틴-프로테아좀 시스템'과 '자가포식(세포 내 단백질 찌꺼기를 스스로 잡아먹는 것처럼 분해해 에너지원으로 재활용하는 과정) 시스템'이 작동하는 것으로 알려져 있다.
생물체가 스트레스 상황에 놓였을 때 생존하기 위해 필수적인 시스템이지만, 언제·어떻게 이들이 조절되는지는 알려지지 않았다.
연구팀은 세포 내 쓰레기이면서 단백질 응고체 전달자로 알려진 p62 단백질이 스트레스를 받으면 자가포식을 촉진하는 새로운 기능이 있음을 발견했다.
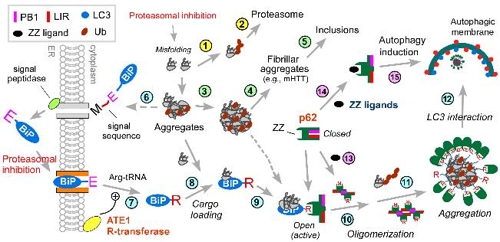
지금까지는 자가포식 활성화와 프로테아좀 활성화 사이의 연관성에 대해서는 알려지지 않았다.
이번 연구를 통해 프로테아좀 경로가 막히면 p62 단백질을 통해 자가포식 경로가 활성화돼 쓰레기 단백질의 분해가 일어나는 것으로 나타났다.
p62 단백질을 조절하면 세포 내 쌓이는 단백질 응고체 처리를 활성화함으로써 암, 노화, 대사 질병 치료에 활용할 수 있을 것으로 기대된다.
김보연 박사는 "대사성 질병의 치료 효과를 높이기 위해서는 프로테아좀과 자가포식의 적절한 활성화 조절이 중요하다"며 "이 저분자 화합물을 이용해 헌팅턴병 원인인 헌팅턴 단백질 쓰레기를 배양세포에서 제거하는 원천기술을 확보할 수 있다"고 말했다.
이번 연구 결과는 국제 학술지 '네이처 커뮤니케이션즈'(Nature Communications) 지난 7월 26일 자 온라인판에 실렸다.
(대전연합뉴스) 박주영 기자 jyoung@yna.co.kr
-
기사 스크랩
-
공유
-
프린트





![월가 "인텔 망가졌다"…구글 9년 만에 최고의 날 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240427071917087.jpg)








