“한올바이오파마, 신약 탄생 기대… 美 불확실성은 한계”
한올바이오파마는 지난 7월 대웅제약과 공동개발 중인 ‘HL036’의 임상 3-2상을 미국 식품의약국(FDA)에 신청했다.
이명선 연구원은 “이번 3-2상은 3-1상 결과를 기반으로 임상 대상자를 세분화하고 평가지표를 변경해 긍정적인 결과가 기대된다”며 “중국에서도 작년 말 3상을 시작, 내년에는 품목허가신청서(BLA) 제출이 가능할 것”이라고 전망했다.
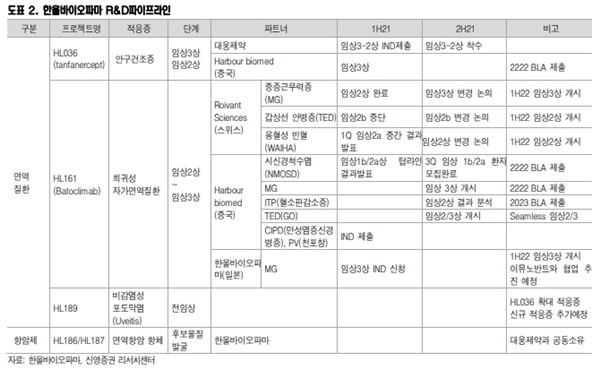
반면 중국 임상은 순항 중이다. 기존 4개 적응증 중 시신경척수염(NMOSD)과 중증근력증(MG)은 내년 중국 BLA 신청이 가시화됐다. 연내 신규 만성염증성신경병증(CIDP)과 천포창(PV) 임상도 개시할 것이란 예상이다.
경쟁사인 아제넥스는 지난 3월 'FcRn' 저해제 에프가티지모드를 중증근무력증 치료제로 FDA에 허가를 신청했다. 결과는 오는 12월17일 발표 예정이다.
이 연구원은 “의약품시장 분석 기업 이벨류에이트파마에 따르면 2026년 에프가티지모드의 매출은 30억달러(약 3조5160억원)로 전망된다”며 “이 같은 기대감을 고려해 HL161 가치 또한 재평가돼야 한다”고 판단했다.
이어 “지난해 HL161의 임상 3-1상 결과가 기대에 미치지 못하고, 미국 임상이 중단되며 주가가 하락했지만 개발 일정만 지연됐을 뿐 개발 추진력은 변함없다”며 “중국 내 사업화 가능성도 높아졌다”고 했다.
이도희 기자
-
기사 스크랩
-
공유
-
프린트



![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[신간] 나무 내음을 맡는 열세 가지 방법](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36534703.3.jpg)