셀트리온 '트룩시마' 내년 유럽서 판매…25조원 바이오시밀러시장 공략 가속
기술경쟁력 1년 이상 앞서…"10년내 톱10 바이오사 도약"
유럽의약품청(EMA) 약물사용자문위원회(CHMP)는 지난 16일 다국적 제약사 로슈의 항암의약품 ‘리툭산’이 처방되는 모든 질환에 트룩시마를 사용해도 된다고 권고했다. 리툭산은 혈액암의 일종인 비호지킨스 림프종, 만성림프구성백혈병 등에 쓰인다. 최종 판매승인이 떨어지면 유럽연합(EU) 28개국과 노르웨이, 아이슬란드, 리히텐슈타인이 속한 유럽경제지역(EEA) 3개국 등 총 31개국에서 별도의 허가 절차 없이 판매할 수 있다.
이번 허가 권고에 따라 셀트리온이 다른 글로벌 제약사보다 1년 이상 앞서 있다는 분석이 나온다. 셀트리온은 2008년 트룩시마 개발에 착수해 2014년 글로벌 임상시험 3상을 했다. 노바티스 자회사인 산도스는 지난 5월에서야 EMA에 리툭산 바이오시밀러 판매허가를 신청했다.
셀트리온은 트룩시마 판매에서도 자신감을 보이고 있다. 이미 유럽에서 관절염 치료제인 램시마 판매를 성공으로 이끌었기 때문이다. 램시마는 지난해 유럽에서 출시된 지 2년 만에 원조 의약품인 레미케이드의 시장 점유율 40%를 장악했다. 노르웨이, 핀란드 등 북유럽 국가에서 램시마의 시장 점유율은 90% 수준이다.
올해 미국에서도 램시마의 판매가 시작됐다. 미국 판매는 다국적 제약사 화이자가 맡고 있다.
셀트리온은 내년 상반기 트룩시마와 허쥬마에 대해서도 미국 식품의약국(FDA)에 판매허가를 신청할 계획이다. 유방암 치료 항체의약품인 ‘허셉틴’의 바이오시밀러인 허쥬마는 지난달 유럽에서 판매 승인 절차에 들어갔다. 램시마·트룩시마·허쥬마의 원조 의약품 시장 규모를 합치면 총 25조원에 달한다.
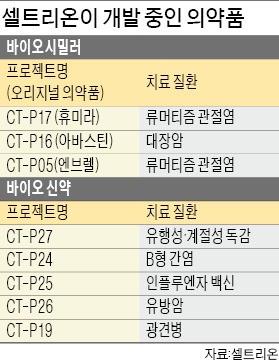
셀트리온은 류머티즘 관절염 치료제 휴미라·엔브렐, 대장암 치료제 아바스틴 등 후속 바이오시밀러의 출시를 준비 중이다. 유행성·계절성 독감 치료제, B형 간염 치료제, 유방암 치료제 등 바이오 신약도 연구개발(R&D)하고 있다. 김형기 셀트리온 사장은 “10년 안에 글로벌 10대 바이오 기업으로 도약하겠다”고 말했다.
조미현 기자 mwise@hankyung.com
-
기사 스크랩
-
공유
-
프린트
![엔화 약세에도…일본은행, 기준금리 동결 [종합]](https://img.hankyung.com/photo/202404/01.36535650.3.jpg)




![구글, 사상 첫 배당 '주당 20센트'…AI 불안감 덮었다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240426073327760.jpg)








![[신간] 나무 내음을 맡는 열세 가지 방법](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36534703.3.jpg)