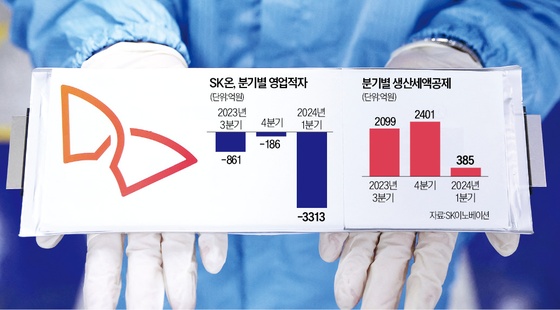
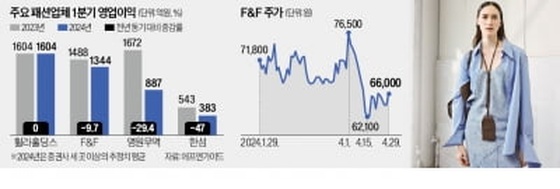
뉴지랩테라퓨틱스, ‘탈레트렉티닙’ 폐암 1차 치료로 임상 확대
표준치료 내성 환자→비소세포폐암 환자
뉴지랩테라퓨틱스는 지난해 9월 식약처로부터 탈레트렉티닙의 폐암 임상 2상을 승인받았다. 폐암 표준치료제인 화이자 ‘잴코리’ 사용 중 내성이 발생한 환자를 대상으로 임상을 진행 중이었다.
회사는 임상 환자 범위를 ‘ROS-1’ 변이 신규 폐암 환자’까지 확대하는 임상 변경을 신청하고 승인받았다. 그 결과 모든 비소세포폐암 환자를 대상으로 국내 임상을 진행할 수 있게 됐다. 앞으로 임상 기간이 단축되고, 약물의 시장성도 확대될 것으로 보고 있다. 잴코리의 경쟁 약물로 개발하겠다는 목표다.
중국에서는 안허트 테라퓨틱스와 이노벤트가 탈렉트렉티닙을 공동 개발 중이다. 중국 임상 2상 결과, 치료 경험이 없는 폐암 환자 21명을 대상으로 객관적 반응률(ORR) 90.5% 및 질병조절률(DCR) 95%를 확인했다. 이 결과는 중국 임상종양학회 연례학술대회(CSCO 2011)에서 발표됐다.
뉴지랩파마 관계자는 “탈레트렉티닙에 대한 국내 임상 1상 및 중국 임상 결과를 근거로 임상 변경을 승인받을 수 있었다”며 “빠른 시일 내 상용화될 수 있도록 최선을 다하겠다"고 말했다.
탈레트렉티닙은 'ROS1'과 'NTRK' 융합 변이를 표적하는 항암제다. 다이이찌산쿄가 개발한 탈렉트렉티닙의 국내 판권은 안허트를 거쳐 2020년에 뉴지랩파마가 도입했다. 현재는 뉴지랩테라퓨틱스에 권리를 이전했다.
박인혁 기자 hyuk@hankyung.com
-
기사 스크랩
-
공유
-
프린트



![3대지수 실적시즌 기대에 상승…테슬라 15%대 급등 [뉴욕증시 브리핑]](https://timg.hankyung.com/t/560x0/photo/202404/01.36566736.1.jpg)