유럽 자문위, 릴리 원형탈모 치료제 승인 권고…세계 첫 치료제 나오나
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
일라이릴리, 연내 美·日서도 승인 기대
HK이노엔도 ‘JAK’ 억제제로 탈모 치료 염두
HK이노엔도 ‘JAK’ 억제제로 탈모 치료 염두
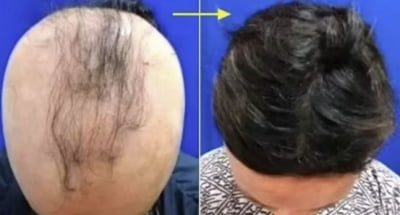
일라이 릴리가 세계 첫 원형탈모 치료제 허가에 한발 더 다가섰다. 자가면역질환 치료제인 ‘올루미언트’(성분명 바리시티닙)를 통해서다. 올루미언트는 이르면 내달 중 ‘최초의 먹는(경구용) 중증 원형 탈모증(AA) 치료제’ 타이틀을 거머쥘 수 있을 것으로 보인다.
일라이 릴리는 지난 20일(현지시간) 올루미언트가 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 경구용 중증 원형 탈모증 치료제 승인에 대한 ‘긍정적 의견(positive opinion)’을 받았다고 밝혔다.
올루미언트는 미국 인사이트 코퍼레이션이 개발해 2009년 릴리에 기술수출한 ‘야누스 키나제(JAK)’ 억제제다. 현재 류머티즘 관절염 및 아토피 피부염 등에 쓰인다. 릴리는 올루미언트를 유럽과 미국, 일본에 중증 원형 탈모증 치료제로 적응증 확대 승인을 신청했다.
릴리 측은 “이번 CHMP의 의견은 유럽 내 최초의 경구용 중증 원형 탈모증 환자 치료제 승인을 위한 첫 번째 단계”라며 “향후 1~2개월 내로 유럽연합 집행위원회(EC)의 결정이 나올 것”이라고 했다.
원형 탈모증은 일종의 자가면역 질환이다. T세포가 모낭세포를 과도하게 공격하면서 모발의 탈락을 유발하는 것으로 알려져 있다. 기존에는 스테로이드계 주사가 주로 사용돼왔으나 원형탈모를 발생시키는 근본적인 원인을 제거하는 데는 한계가 있었다. 스테로이드로 인해 피부 염증, 호르몬 이상 등의 부작용도 동반됐다.
올루미언트는 JAK 저해제로 'JAK1'과 'JAK2'를 선택적으로 억제해 원형 탈모를 유발하는 세포의 신호 전달을 방해한다.
릴리는 EMA에 신약허가를 신청하면서, 중증 원형 탈모증 환자 1200명을 대상으로 36주 간 관찰한 두 가지(BRAVE-AA1, BRAVE-AA2) 임상 3상 결과를 근거로 제시했다. 두 시험 모두 1차 평가지표는 탈모 심각성 평가 척도(SALT)였다. SALT 점수가 20점 이하인 환자의 비율을 확인했다. 이는 전체 두피의 80% 이상에서 모발 재성장이 나타난 것을 의미한다.
598명 환자 대상으로 진행한 BRAVE-AA1에서 SALT 20점 이하 환자는 올루미언트 4mg군에서 35.2%, 2mg군에서 21.7%로 나타났다. 위약군은 5.3%에 그쳤다. 490명 대상 BRAVE-AA2에서도 올루미언트 4mg군 32.5%, 2mg군 17.3%에 비해 위약군에서는 2.6%로 확인됐다. 두 시험 모두 위약군 대비 P값도 0.001 이하였다. P값은 임상에서 집단 간 차이가 통계적으로 유의미한지 판단하는 지표다. 통상 P값이 0.05 이하면 통계적 유의성을 충족했다고 본다.
두 가지 임상 3상 후 16주를 추가로 추적 관찰한 52주 결과도 이와 비슷했다. 올루미언트 4mg군의 39%가 SALT 점수 20점 이하에 도달하며 유의미한 결과를 도출했다. 이 중 74.1%는 52주째 SALT 점수가 10점 이하로 모발이 90% 이상 다시 자랐다. 2mg군에서는 22.6%가 80% 이상에서 모발 재성장을 경험했고, 이 중 67.5%가 SALT 10점 이하에 도달했다.
안전성도 확인됐다. 부작용으로 인해 치료를 중단한 환자는 두 3상에서 모두 2.6% 이하로 임상 중단을 요하는 수준은 아니었다. 치료로 발생한 부작용 대부분 경증 또는 중등도였다.
패트릭 존슨 릴리 수석부사장은 “올해 유럽 최초의 성인 중증 원형 탈모증 치료제 승인과 함께 다른 국가에서의 추가 허가를 기대하고 있다”고 말했다.
릴리는 지난해 말 미국 식품의약국(FDA)에도 올루미언트 판매 허가를 신청했다. FDA는 지난 2월 올루미언트를 성인 중증 원형 탈모증 치료제로 우선심사(priority review)를 승인했다. FDA는 2020년 올루미언트를 원형 탈모증에 대한 혁신치료제(BTD)로 지정했다. 릴리는 연내 미국 및 일본에서 추가 승인을 받을 수 있을 것으로 보고 있다.
올루미언트를 가장 빠르게 추격하고 있는 건 화이자의 ‘리틀레시티닙’이다. 화이자는 지난해 8월 리틀레시티닙의 임상 2b·3상 결과를 공개했다. 이에 따르면 24주간 치료받은 환자의 17~28%가 SALT 20점 이하에 도달했다.
국내에서는 HK이노엔이 JAK1 억제 신약 후보물질 ‘IN-A002’를 개발 중이다. 현재 성인 30명 대상으로 국내 임상 1상을 진행 중이다. 연말 임상 종료를 예상하고 있다. HK이노엔 역시 IN-A002를 류머티즘 관절염, 아토피 피부염과 함께 원형 탈모 치료제로 개발한단 계획이다.
이도희 기자 tuxi0123@hankyung.com
일라이 릴리는 지난 20일(현지시간) 올루미언트가 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 경구용 중증 원형 탈모증 치료제 승인에 대한 ‘긍정적 의견(positive opinion)’을 받았다고 밝혔다.
올루미언트는 미국 인사이트 코퍼레이션이 개발해 2009년 릴리에 기술수출한 ‘야누스 키나제(JAK)’ 억제제다. 현재 류머티즘 관절염 및 아토피 피부염 등에 쓰인다. 릴리는 올루미언트를 유럽과 미국, 일본에 중증 원형 탈모증 치료제로 적응증 확대 승인을 신청했다.
릴리 측은 “이번 CHMP의 의견은 유럽 내 최초의 경구용 중증 원형 탈모증 환자 치료제 승인을 위한 첫 번째 단계”라며 “향후 1~2개월 내로 유럽연합 집행위원회(EC)의 결정이 나올 것”이라고 했다.
원형 탈모증은 일종의 자가면역 질환이다. T세포가 모낭세포를 과도하게 공격하면서 모발의 탈락을 유발하는 것으로 알려져 있다. 기존에는 스테로이드계 주사가 주로 사용돼왔으나 원형탈모를 발생시키는 근본적인 원인을 제거하는 데는 한계가 있었다. 스테로이드로 인해 피부 염증, 호르몬 이상 등의 부작용도 동반됐다.
올루미언트는 JAK 저해제로 'JAK1'과 'JAK2'를 선택적으로 억제해 원형 탈모를 유발하는 세포의 신호 전달을 방해한다.
릴리는 EMA에 신약허가를 신청하면서, 중증 원형 탈모증 환자 1200명을 대상으로 36주 간 관찰한 두 가지(BRAVE-AA1, BRAVE-AA2) 임상 3상 결과를 근거로 제시했다. 두 시험 모두 1차 평가지표는 탈모 심각성 평가 척도(SALT)였다. SALT 점수가 20점 이하인 환자의 비율을 확인했다. 이는 전체 두피의 80% 이상에서 모발 재성장이 나타난 것을 의미한다.
598명 환자 대상으로 진행한 BRAVE-AA1에서 SALT 20점 이하 환자는 올루미언트 4mg군에서 35.2%, 2mg군에서 21.7%로 나타났다. 위약군은 5.3%에 그쳤다. 490명 대상 BRAVE-AA2에서도 올루미언트 4mg군 32.5%, 2mg군 17.3%에 비해 위약군에서는 2.6%로 확인됐다. 두 시험 모두 위약군 대비 P값도 0.001 이하였다. P값은 임상에서 집단 간 차이가 통계적으로 유의미한지 판단하는 지표다. 통상 P값이 0.05 이하면 통계적 유의성을 충족했다고 본다.
두 가지 임상 3상 후 16주를 추가로 추적 관찰한 52주 결과도 이와 비슷했다. 올루미언트 4mg군의 39%가 SALT 점수 20점 이하에 도달하며 유의미한 결과를 도출했다. 이 중 74.1%는 52주째 SALT 점수가 10점 이하로 모발이 90% 이상 다시 자랐다. 2mg군에서는 22.6%가 80% 이상에서 모발 재성장을 경험했고, 이 중 67.5%가 SALT 10점 이하에 도달했다.
안전성도 확인됐다. 부작용으로 인해 치료를 중단한 환자는 두 3상에서 모두 2.6% 이하로 임상 중단을 요하는 수준은 아니었다. 치료로 발생한 부작용 대부분 경증 또는 중등도였다.
패트릭 존슨 릴리 수석부사장은 “올해 유럽 최초의 성인 중증 원형 탈모증 치료제 승인과 함께 다른 국가에서의 추가 허가를 기대하고 있다”고 말했다.
릴리는 지난해 말 미국 식품의약국(FDA)에도 올루미언트 판매 허가를 신청했다. FDA는 지난 2월 올루미언트를 성인 중증 원형 탈모증 치료제로 우선심사(priority review)를 승인했다. FDA는 2020년 올루미언트를 원형 탈모증에 대한 혁신치료제(BTD)로 지정했다. 릴리는 연내 미국 및 일본에서 추가 승인을 받을 수 있을 것으로 보고 있다.
올루미언트를 가장 빠르게 추격하고 있는 건 화이자의 ‘리틀레시티닙’이다. 화이자는 지난해 8월 리틀레시티닙의 임상 2b·3상 결과를 공개했다. 이에 따르면 24주간 치료받은 환자의 17~28%가 SALT 20점 이하에 도달했다.
국내에서는 HK이노엔이 JAK1 억제 신약 후보물질 ‘IN-A002’를 개발 중이다. 현재 성인 30명 대상으로 국내 임상 1상을 진행 중이다. 연말 임상 종료를 예상하고 있다. HK이노엔 역시 IN-A002를 류머티즘 관절염, 아토피 피부염과 함께 원형 탈모 치료제로 개발한단 계획이다.
이도희 기자 tuxi0123@hankyung.com

![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


