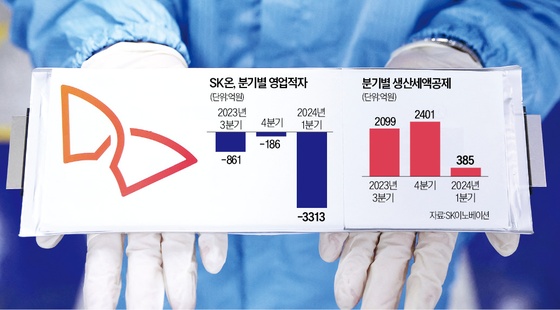
美 안허트 폐암약, FDA 혁신치료제 지정…뉴지랩 국내 2상 중
탈레트렉티닙은 ‘ROS1’과 ‘NTRK’ 융합 변이 단백질의 활성을 차단 및 억제하는 표적항암제다. FDA는 탈레트렉티닙의 중국 임상 2상 및 미국과 일본에서 각각 진행된 임상 1상 예비 결과를 토대로 혁신치료제 지정을 승인했다.
중국 2상 예비 결과는 지난 6월 미국임상종양학회(ASCO)에서 발표됐다. 티로신키나제억제제(TKI) 치료 경험이 없는 ROS1 융합 양성 비소세포폐암 환자 67명에 대한 임상 결과, 객관적 반응률(ORR)은 92.5%를 기록했다. 질병통제율(DCR)은 95.5%였다. ‘잴코리’(성분명 크리조티닙) 치료 경험이 있는 환자에 대해서는 ORR 50%와 DCR 78.9%를 기록했다.
전이 및 측정 가능한 뇌 병변이 있는 12명의 환자에서 ORR 및 DCR은 각각 91.7%과 100%였다. ROS1 G2032R 내성 돌연변이가 있는 5명의 환자 중 4명은 부분관해(PR), 1명은 안정병변(SD)이 확인됐다.
BTD는 심각하거나 생명을 위협하는 질환의 약물 개발을 촉진하기 위한 제도다. BTD로 승인받기 위해서는 해당 약물이 기존 치료제에 비해 적어도 하나 이상의 평가 변수에서 상당한 개선을 보인다는 증거가 필요하다.
BTD에 지정되면 품목허가를 위해 준비된 자료부터 먼저 제출해 검토받는 순차심사(롤링리뷰), 다른 의약품보다 먼저 심사하는 우선심사 등의 혜택이 주어진다.
리안 리 안허트 최고의료책임자는 "탈레트렉티닙은 다른 ROS1 억제제와 비교해 우수한 뇌 침투 및 두개내(intracranial) 항암활성을 확인했다“며 ”새로운 치료 대안이 필요한 ROS1 양성 비소세포폐암 미국 환자를 위해 FDA와 지속적으로 대화하겠다“고 말했다.
다이이찌산쿄가 개발한 탈레트렉티닙의 국내 판권은 안허트를 거쳐 2020년에 뉴지랩파마가 도입했다. 현재는 자회사인 뉴지랩테라퓨틱스에 권리를 이전했다.
뉴지랩테라퓨틱스는 지난해 9월 폐암 표준치료제인 잴코리 내성 ROS1 양성 비소세포폐암 환자를 대상으로 탈레트렉티닙의 국내 임상 2상을 승인받았다. 12월에 첫 환자 투약을 시작했다. 올 6월에는 전체 ROS1 양성 비소세포폐암 환자로 대상을 확대하는 임상시험계획 변경을 승인받았다.
박인혁 기자 hyuk@hankyung.com
-
기사 스크랩
-
공유
-
프린트




![3대지수 실적시즌 기대에 상승…테슬라 15%대 급등 [뉴욕증시 브리핑]](https://timg.hankyung.com/t/560x0/photo/202404/01.36566736.1.jpg)