"AZ 백신, 미 FDA 승인 신청 지연…데이터 정리 애 먹어"
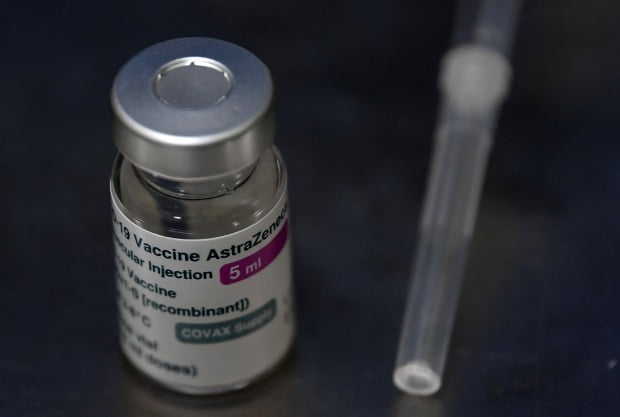
29일(현지시간) 월스트리트저널(WSJ)에 따르면 AZ는 긴급 사용 신청에 필요한 데이터를 정리하느라 애를 먹고 있는 상황이다.
지난달 AZ 측은 4월 중순까지 FDA에 백신 긴급사용 승인을 신청하겠다고 발표했다. 그러나 소식통들에 따르면 최근 미 당국에 'FDA 신청 작업을 마무리하기 위해 5월 중순까지 시간이 필요하다'고 밝혔다.
AZ는 4개월 동안 영국에서 진행된 자사 백신의 실제 접종과 관련한 예방 효과, 바이러스 전염, 안전 등에 관한 데이터를 정리해 편집하는 데에 오랜 시간을 소요하고 있는 것으로 알려졌다.
앞서 화이자, 모더나, 존슨앤드존슨 계열사 얀센은 대규모 임상시험 결과만으로 FDA의 긴급사용 승인을 받았다. 그러나 AZ는 FDA 신청에 앞서 이미 유럽과 아시아 등 세계 각국에서 광범위하게 실제 접종을 진행 중이다.
AZ 백신은 일부 접종자들에서 혈소판 감소를 동반한 희귀 혈전이 발생해 논란에 휩싸인 바 있다. 유럽 등 세계 각국은 희귀 혈전 발생 위험보다 코로나19 발병에 따른 위험이 더 크다고 판단해 AZ 백신의 사용을 권고하고 있으나 사용 연령을 일부 제한하고 있다.
미국에서는 AZ와 비슷한 방식으로 개발된 얀센 백신이 역시 희귀 혈전 문제로 일시적으로 사용 중단된 바 있다.
한편 우리나라 정부는 다음달부터 65∼74세 어르신과 30세 이상 유치원·어린이집·초등학교(1·2학년) 교사 및 돌봄인력, 만성중증호흡기 질환자에 대한 AZ 백신 접종을 시작한다.
정부가 상반기 도입을 확정한 백신은 총 1808만8000회분(904만4000명분)이며 이 중 59%가 AZ 백신이다.
차은지 한경닷컴 기자 chachacha@hankyung.com
-
기사 스크랩
-
공유
-
프린트












![진짜 노동하려면 ‘바쁘지 말 것, 바쁘다고 말하지도 말 것’ [서평]](https://timg.hankyung.com/t/560x0/photo/202404/01.36554781.3.jpg)