리메드, 우울증 치료용 경두개자기자극기 美 품목허가
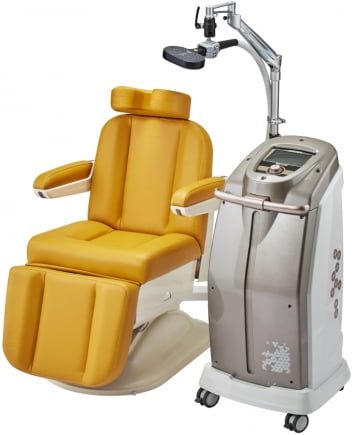
510K 인증은 의료기기 시판 전 성능 증명 제도다. 미국 의료기기 시장에 진출하려면 인증을 필수적으로 받아야 한다는 설명이다.
리메드는 2013년 ALTMS의 국내 허가에 이어, 지난해 11월 FDA의 품목허가를 받았다. FDA 허가 이후 치료시간을 단축할 수 있도록 소프트웨어 기능을 향상시켜, 이번에 스페셜510(K) 허가를 받았다고 했다.
리메드는 지난해 5월 만성통증 치료용 신경자기자극(NMS) 장비인 ‘Talent-Pro’에 대해 FDA의 시판허가를 받았다. 이어 ALTMS를 승인받았다.
고은현 리메드 대표는 “지난해 두 번의 FDA 승인에 이어 올 들어 성능을 개선한 제품에 대해서도 승인받는 등 제품 연구개발을 지속하고 있다”며 “이번 승인을 통해 미국에서의 ALTMS 출시가 앞당겨질 것으로 기대한다”고 말했다.
김예나 기자
-
기사 스크랩
-
공유
-
프린트




!["버핏, 애플 팔고 '9조' 베팅한 곳이…" 6개월 만에 깜짝 공개 [대가들의 포트폴리오]](https://timg.hankyung.com/t/560x0/photo/202405/01.36729398.1.jpg)