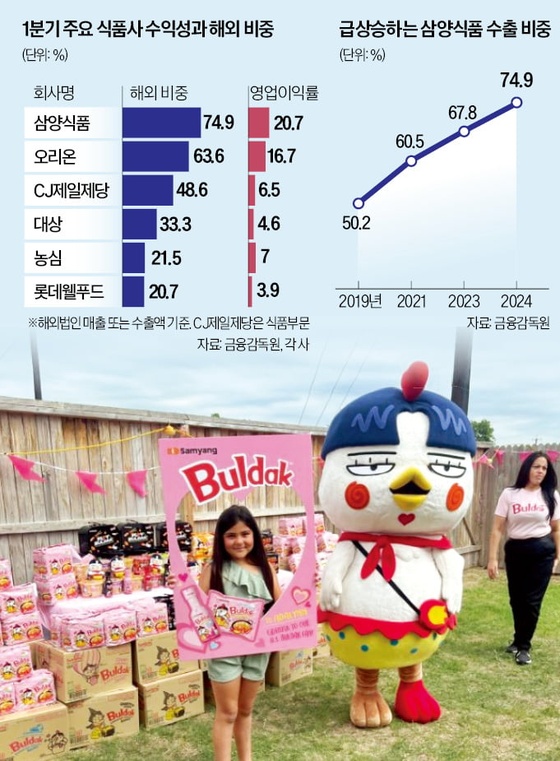
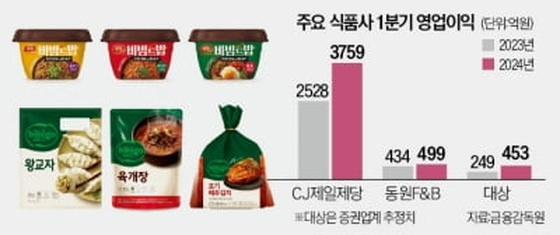
엔케이맥스, 동종 NK세포치료제 고형암 국내 1상 승인
이번 임상은 고려대 안암병원 및 신촌 세브란스병원에서 진행된다. 표준요법에 실패한 전이 또는 국소적으로 진행된 고형암 환자 9명이 대상이다. SNK02의 내약성, 안전성 평가 및 항종양 효과를 확인하는 것이 목표다.
임상에서는 3개의 환자군(코호트)로 나눠 임상 2상에 대한 최대내약용량(MTD)과 적정용량(RP2D)을 탐색할 예정이다. SNK02 30억 개, 60억 개, 90억 개를 각각의 환자군에 정맥투여한다.
앞서 엔케이맥스는 고형암 환자를 대상으로 SNK02 미국 임상 1상을 식품의약국(FDA)으로부터 승인 받고 지난 8월 첫 환자 투약을 마쳤다. 국내에서는 위암 환자를 대상으로 SNK02 1·2a상 IND를 승인 받아 투약을 준비 중이다.
엔케이맥스 관계자는 “이번 임상 1상을 통해 여러 고형암에 대한 SNK02의 안전성 데이터 및 치료효과를 탐색할 예정”이라며 “미국과 한국에서 동종 NK세포치료제 임상이 동시에 진행되는 만큼 빠른 임상 2상 진입과 상용화가 기대된다”고 말했다.
박인혁 기자 hyuk@hankyung.com
-
기사 스크랩
-
공유
-
프린트

!["돈 빌릴 곳이 없다"…'초비상' 바이오텍 주주에 손 벌리는 이유 [이해진의 글로벌바이오]](https://img.hankyung.com/photo/202310/01.34741318.3.jpg)


![서학개미 뒤집어졌다…다우지수 종가기준 첫 4만선 돌파 [뉴욕증시 브리핑]](https://timg.hankyung.com/t/560x0/photo/202405/AD.36579999.1.jpg)