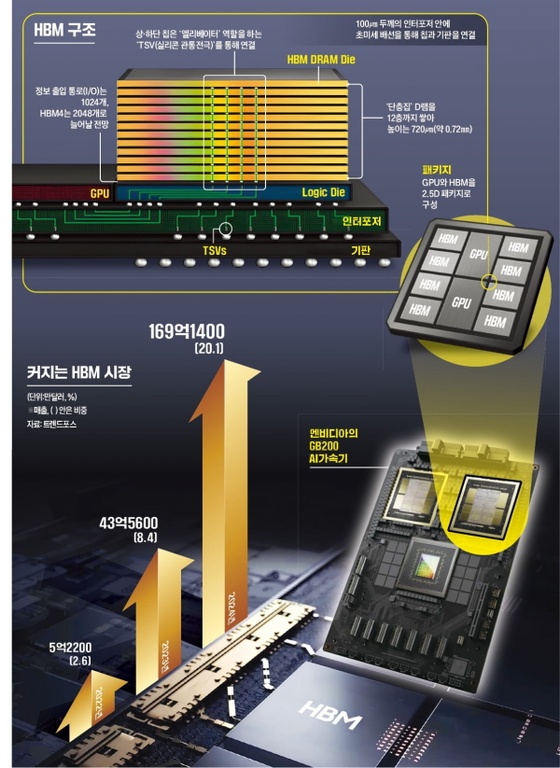
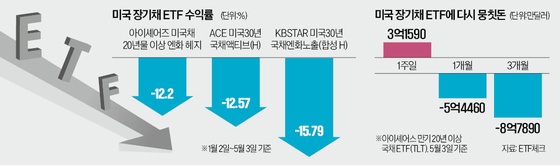
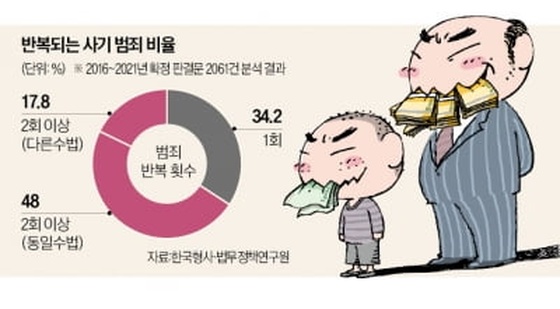
메지온, 유데나필 임상 3상 계획 변경 승인…"허가 일정과 무관"
선천성 단심실증 환자를 대상으로 하는 임상 3상은 승인 시 유데나필을 1년간 복용하는 것으로 설계됐다. 이후 1년간의 투여 기간이 끝나가는 시점인 2018년 6월에 환자와 담당 임상연구자의 의견을 받아들여 복용기간을 1년 더 추가하는 변경안을 FDA에서 승인받았다. 이번 2차 변경 승인은 2018년 6월 1년 연장에 이어 두번째로 1년이 더 추가 연장하는 것이다. 단심실증 환자는 최종적으로 유데나필을 36개월 투약한다.
이는 유데나필의 시판 허가 전 단심실증 환자들의 약 복용이 중단되는 상황을 막기 위한 조치란 설명이다.
통상적인 임상 계획 변경은 FDA 접수 후 승인까지 45일 정도의 기간이 필요하다. 그러나 이번 승인은 7일 만에 전격적으로 이뤄졌다고 회사 측은 전했다. 이는 단심실증 환자 치료제에 대한 FDA의 의지와 의료 현장에서 환자의 수요가 강하다는 것을 의미한다고 회사는 해석하고 있다.
메지온 관계자는 "이번 투여기간 연장은 FDA의 판매허가 일정과는 무관하다"며 "회사는 이번 사례 뿐만 아니라 향후 FDA로부터 받는 모든 공식문서 및 임상시험 진행상황에 대해 투자자들에게 즉시 공개할 수 있도록 하겠다"고 말했다.
메지온은 현재 임상 3상 결과에 대한 검수 작업에 들어가 있다.
한민수 한경닷컴 기자 hms@hankyung.com
-
기사 스크랩
-
공유
-
프린트