SK바이오팜, 수면장애치료신약 FDA 허가 신청
국내 중추신경계 신약 개발 중 최초로 글로벌 상업화 앞둬
시장 1위 '자이렘' 대비 졸림증 2배 이상 개선‥차세대 약물로서 가능성 입증
빠르면 2019년 초 미국 판매 전망. 아시아 12개국으로 판매 확대

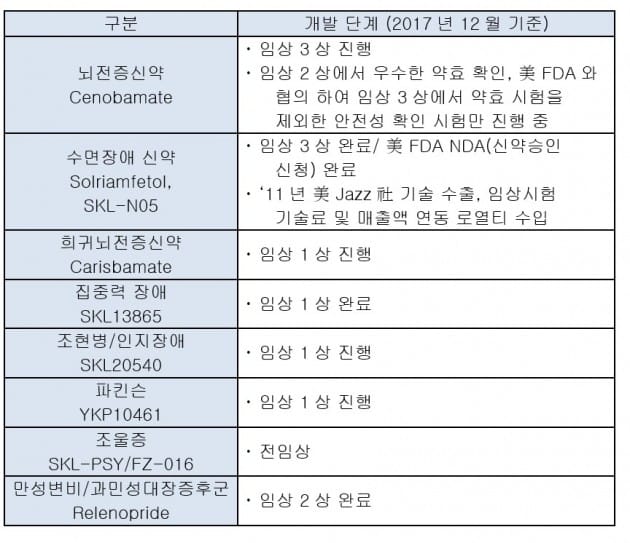
SK바이오팜은 2011년 SKL-N05 임상 1상을 완료한 뒤 미국 재즈에 기술 수출했으며 공동개발을 통해 올해 임상 3상 약효시험을 마무리했다. 기면증과 수면무호흡증으로 인한 수면장애 환자 880명을 대상으로 한 임상 3상 시험에서 위약 대비 주간 졸림증이 현저히 개선됐으며 환자의 주관적 졸림 정도도 시장 선도 약물인 '자이렘(Xyrem)' 대비 2배 이상 개선한 것으로 나타났다. 이같은 임상 결과는 지난 6월 미국에서 열린 세계 최고 권위의 수면전문학회(Annual meeting of the Associated Professional Sleep Societies LLC)에서 발표돼 업계의 주목을 받았다.
미국 재즈 사는 수면 장애 치료제 시장에서 매년 1조원 이상의 매출을 올리는 자이렘을 판매 중이며 자이렘의 특허 만료를 앞두고 SKL-N05를 후속 차세대 약물로 육성할 계획인 것으로 알려졌다. SK바이오팜은 SKL-N05가 미국 시장에 성공적으로 안착하면 아시아를 비롯한 다른 해외 시장까지 판로를 확대할 계획이다.

SK는 불확실성 속에서도 최태원 회장의 강력한 의지에 따라 신약 개발에 장기간 투자를 지속해왔다. 2007년 지주회사 체제 전환 후 신약 개발 조직을 지주회사 직속으로 두고 그룹차원에서 투자와 연구를 진행했다는 게 회사 측의 설명이다.
SK바이오팜은 신약개발이 어렵다고 알려진 중추신경계 분야에서 혁신 신약 개발에 집중하고 있다. 중추신경계 질환은 난치성 환자가 많아 새로운 신약에 대한 요구가 크다. 시장 규모는 2014년 810억 달러 규모로 항암분야와 더불어 가장 큰 시장 중 하나이며 2021년에는 920억 달러 규모로 성장할 것으로 전망된다.
조정우 SK바이오팜 사장은 “중추신경계 분야에서 지속적으로 혁신적인 신약을 개발·출시하고 그동안 축적해온 역량을 기반으로 항암제 등 신규 질환 영역의 신약 개발을 통해 2020년까지 기업가치 10조원 규모의 글로벌 종합제약사로 도약할 계획”이라고 밝혔다.
-
기사 스크랩
-
공유
-
프린트
!["투자와 연쇄창업자 노하우 전수를 동시에…K스타트업 투자공식 바꾸겠다" [최진석의 실리콘밸리 줌인센터]](https://img.hankyung.com/photo/202405/01.36579201.3.jpg)



![매파 연준 우려에 나스닥 2% 급락 [출근전 꼭 글로벌브리핑]](https://timg.hankyung.com/t/560x0/photo/202405/B20240501062439197.jpg)








