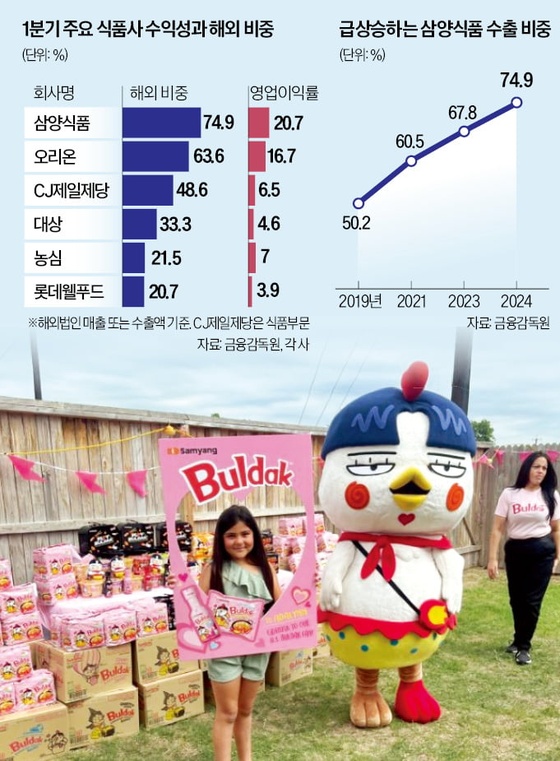
삼성바이오 유럽 내 유방암 바이오시밀러 시장 선점 나선다
셀트리온 동일 제품 '허쥬마', 최종 허가 올해 넘길 듯
삼성바이오에피스의 '온트루잔트'(SB3)가 유럽 최초로 허가받는 허셉틴 바이오시밀러(바이오의약품 복제약)가 될 전망이다.
삼성바이오에피스가 유럽 내에서 유방암 바이오시밀러 시장에 가장 먼저 진입, 개척하는 '퍼스트무버'가 될 가능성이 짙어졌다.
유방암 치료제 허셉틴의 바이오시밀러인 온트루잔트는 15일(현지시간) 유럽의약품청(EMA)의 약물사용자문위원회(CHMP)로부터 '긍정 의견'을 획득해 연내 허가가 가시화됐다.
대개 CHMP의 긍정 의견 발표 후 2∼3개월 이내에 최종 허가가 나온다.
이 때문에 삼성바이오에피스는 온트루잔트가 유럽 최초로 승인받는 허셉틴 바이오시밀러가 될 것으로 보고 있다.
특히 비슷한 시기에 허가를 신청한 경쟁사를 제치고 유럽시장에서 유리한 위치를 선점할 것이라는 데 기대를 감추지 못하고 있다.
이에 앞서 허셉틴 바이오시밀러를 가장 먼저 승인받을 것으로 보였던 마일란과 바이오콘은 생산시설 문제로 지난달 신청을 자진 철회한 바 있다.
셀트리온의 허셉틴 바이오시밀러인 '허쥬마' 역시 연내 최종 허가가 불투명한 상태다.
셀트리온은 삼성바이오에피스보다 약 한 달 뒤인 지난해 10월께 EMA에 허쥬마를 허가해달라고 신청했다.
셀트리온 관계자는 "허쥬마의 최종 허가는 해를 넘길 것으로 보고 있다"면서 "CHMP 의견을 올해 받는 것을 목표로 내년 초에는 허가까지 마무리할 계획"이라고 말했다.
이에 따라 당분간 삼성바이오에피스의 온트루잔트가 유럽 내 허가받은 유일한 허셉틴 바이오시밀러 자리를 유지할 것으로 보인다.
다만 구체적인 출시 시기는 확정되지 않았다.
삼성바이오에피스는 온트루잔트의 유럽 출시 시기는 최종 허가를 받은 후 현지 파트너사와 협의해 결정할 예정이다.
판매는 현지 영업 파트너사인 머크(Merck)사가 맡는다.
삼성바이오에피스는 유럽시장 선점 외에도 보유하고 있는 바이오시밀러 제품군이 자가면역질환 치료제에서 항암제로 확대된다는 데 의미를 부여했다.
삼성바이오에피스가 지금까지 유럽에서 허가받은 3종 바이오시밀러(베네팔리, 플릭사비, 임랄디)는 모두 자가면역질환 치료제다.
최종 허가가 완료되면 기존 자가면역질환 치료제 외에 처음으로 항암 바이오시밀러를 승인받는 셈이 된다.
삼성바이오에피스 관계자는 "온트루잔트의 최종 허가가 이뤄지면 글로벌 매출 10위권 의약품의 바이오시밀러를 최다 보유한 기업이 될 것"이라며 "총 4종의 바이오시밀러를 보유하게 돼 글로벌 시장에서의 경쟁 우위도 굳건해질 것으로 예상한다"고 말했다.
(서울연합뉴스) 김잔디 기자 jandi@yna.co.kr
-
기사 스크랩
-
공유
-
프린트





!["테일러 스위프트 남친도 팔았다"…세금 감면받을 권리 [김리안의 에네르기파WAR]](https://timg.hankyung.com/t/560x0/photo/202405/01.36747482.1.jpg)