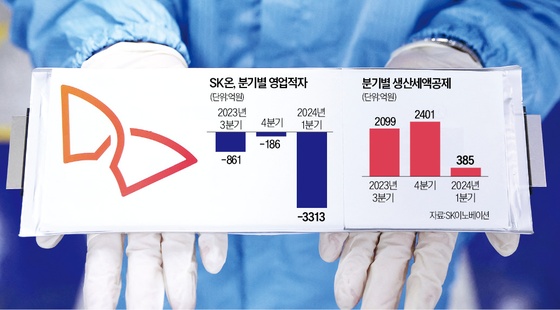
"알테오젠, 연내 아일리아 시밀러 3상 신청·판권 계약 기대"
엄민용 연구원은 "알테오젠은 아일리아 바이오시밀러를 2024년까지 임상 3상 완료를 목표로 개발 중"이라며 "내년 1분기 3상 투약 개시를 위해 4분기 중 임상 신청을 목표하고 있다"고 말했다. 알테오젠은 또 연내 아일리아 바이오시밀러의 판권 계약을 계획 중이라고 했다.
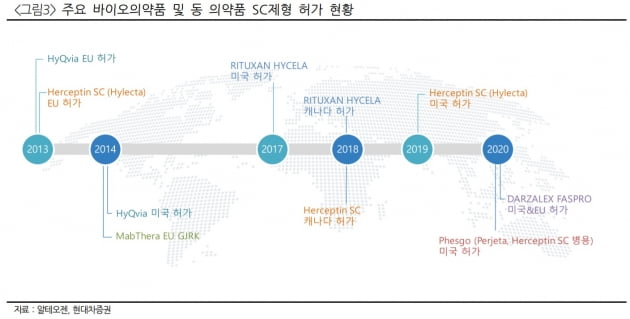
엄 연구원은 MSD가 진행하고 있는 키트루다SC의 임상 개발에 알테오젠의 기술(ALT-B4)이 적용됐을 것으로 추정 중이다. MSD는 지난 8월23일 키트루다SC 임상 1상에 히알루로니다제에 면역반응을 보이는 환자는 참여할 수 없다는 내용을 임상정보 사이트 클리니컬트라이얼즈에 추가했다. 히알루로니다제는 정맥주사 제형을 SC제형으로 바꾸는 데 쓰이는 효소다. 히알루로니다제를 이용한 SC제형 변경 기술은 세계에서 할로자임과 알테오젠만이 갖고 있다.
할로자임은 글로벌 제약사들과 SC제형 변경 기술에 관한 독점 이전계약을 체결했기 때문에, 동일 기전의 약물에는 쓰일 수 없다. 할로자임은 키트루다와 같은 기전의 면역관문억제제 옵디보를 BMS와 함께 SC제형으로 개발하고 있다. MSD가 알테오젠 기술을 이전받았을 것으로 엄 연구원이 추측하는 이유다.
그는 "할로자임의 대표 후보물질은 로슈의 페스고, BMS의 'PD1+LAG3'와 'TIM-3' 항체, 아제넥스의 'FcRn', 얀센의 다잘렉스 등"이라며 "이와 동일한 기전의 치료제를 개발 중인 제약사는 알테오젠과 SC를 개발할 수밖에 없고, MTA 10건이 이와 연관있음을 회사 측은 시사했다"고 전했다.
엄 연구원은 "내년 키트루다SC의 임상 성공 시 알테오젠 ALT-B4의 가치는 전혀 다른 위치에서 평가될 것"이라고 했다. 2022년에는 성형외과와 피부과에서 쓰이는 테르가제의 임상 성공 후 제품 출시로 현금흐름도 창출될 것으로 봤다.
한민수 기자
-
기사 스크랩
-
공유
-
프린트



![34년만 엔·달러 환율 160엔 돌파…환율 출렁인 이유는? [한경 외환시장 워치]](https://timg.hankyung.com/t/560x0/photo/202404/01.36562723.1.jpg)