K바이오 '유종의 미' 거둘까
연내 美임상 3상 결과 3건 더 공개
셀리버리, 기술수출 논의 가속화
헬릭스미스, 임상오염 조사 발표
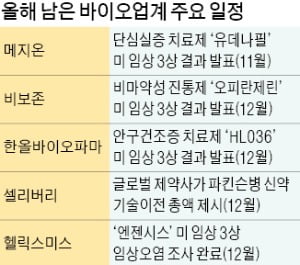
비보존의 비마약성 진통제 ‘오피란제린’의 미국 임상 3상 결과는 오는 12월 발표된다. 비보존은 지난 5월부터 복부성형술을 받은 307명을 대상으로 임상을 해 3개월 만에 마쳤다. 임상에서는 오피란제린을 수술 시작 전에 투여해 수술 도중과 수술 후 사용하는 마약성 진통제 오피오이드의 투약을 최소화하고 퇴원 뒤에는 일반의약품인 타이레놀만으로 통증을 제어할 수 있는지 확인했다. 비보존 관계자는 “오피오이드 오남용으로 미국에서만 매년 4만여 명이 사망한다”며 “수술 후 1차 통증치료제로 널리 쓰이는 오피오이드를 대체할 수 있을 것”이라고 말했다. 한올바이오파마가 대웅제약과 공동 개발 중인 안구건조증 치료제 ‘HL036’의 미국 임상 3상 결과도 12월에 나온다.
기술수출에서도 결실이 맺어질지 주목된다. 셀리버리가 개발 중인 파킨슨병 신약후보물질(파이프라인) ‘iCP-Parkin’의 기술수출이 연내에 가시화될 전망이다. 회사 관계자는 “다국적제약사 한 곳이 12월에 기술이전 대가 총액을 제시할 예정”이라고 말했다. 중국 제약사와는 올초부터 췌장암 치료제 ‘iCP-SOCS3’의 기술이전을 협의하고 있다. 이 중국 제약사는 영장류 독성시험을 시행해 안전성을 검증할 것을 요구했다. 셀리버리는 지난 7월 독성시험을 완료하고 자료를 제출했으나 물질의 독성이 체내에서 어떻게 퍼지는지 보여주는 데이터를 다시 요구받았다. 셀리버리는 스페인의 한 비임상 분석기관에 위탁해 이달 분석을 완료할 계획이다.
미국 임상 3상에서 임상 오염이 발생해 신뢰성에 큰 타격을 입은 헬릭스미스는 연내 임상 오염에 대한 조사 결과를 내놓는다. 이 회사는 골드만삭스가 임상 수행 역량에 문제를 제기하는 등 이번 사태로 뼈아픈 지적을 받고 있다. 김선영 헬릭스미스 대표는 “확실히 규명되기 전까지 원인을 특정하긴 힘들지만 임상 도중 임상수행수탁기관(CRO)을 교체하는 과정에서 문제가 생겼을 가능성이 있다”고 했다.
임유 기자 freeu@hankyung.com
-
기사 스크랩
-
공유
-
프린트


![벅셔 주총장 팀쿡 등장…버핏은 애플 지분 13% 팔았다 [오마하 현장 리포트]](https://timg.hankyung.com/t/560x0/photo/202405/B20240505014502147.jpg)






![[이 아침의 바이올리니스트] 유럽 오케스트라 벽 뚫은 거장들의 파트너, 이지혜](https://timg.hankyung.com/t/560x0/photo/202405/AA.36620719.3.jpg)