주목받는 HLB ‘리보세라닙’…글로벌 진출 확대 가능성은
“올해 1~2건 신약허가신청 계획”
18일 HLB에 따르면 항서제약과 HLB는 최근 간세포암 1차 치료에 대한 리보세라닙과 캄렐리주맙 병용 3상에서 통계적 유의성을 확보했다. 1차 유효성 지표인 전체생존기간(OS)과 무진행생존기간(PFS)을 모두 충족했다고 했다.
이 소식에 HLB 주가는 지난 11일 이후 6거래일 연속 상승세를 이어가고 있다. 현재 간암에서는 2007년 미국 식품의약국(FDA)에서 허가받은 소라페닙이 1차 치료제로 사용되고 있다. 2020년에는 'VEGFR' 표적항암제 아바스틴(성분명 베바시주맙)과 'PD-1' 면역관문억제제 티센트릭(아테졸리주맙)의 병용요법이 허가받았다. 두 약물의 결합으로 간암 치료에서 표적항암제와 면역항암제 병용요법의 효과가 입증됐다고 HLB 측은 전했다.
HLB와 항서제약이 개발하고 있는 리보세라닙과 캄렐리주맙도 각각 VEGFR 표적항암제와 PD-1 면역관문억제제의 병용이다.
업계 관계자는 “최근 들어 많은 항암제들이 개발되면서 암 치료율이 평균 70%를 웃돌고 있지만, 간암은 아직까지 35% 수준에 그친다”고 말했다. 간암 1차 치료제로서 리보세라닙과 캄렐리주맙 병용이 주목받은 이유다.
“中 임상 글로벌로 확대 가능…올해 1~2건 NDA 예정”
HLB는 리보세라닙이 간암에서 나아가 다양한 암종을 대상으로 글로벌 3상에 진입할 가능성이 있다고 했다. 항서제약이 진행한 여러 건의 중국 임상 결과를 바탕으로, 후기 글로벌 임상을 확대할 수 있을 것이란 판단이다.이번 간암 3상 역시 리보세라닙의 중국 개발 및 판매 권리를 가진 항서제약이 중국에서 2상까지 마친 후, 이를 글로벌 3상으로 확대하면서 이뤄졌다. 항서제약의 중국 내 1상과 2상 결과를 인정받아 미국 식품의약국(FDA) 등 각국의 승인으로 3상에 직행했다는 것이다.
항서제약은 현재 중국에서 리보세라닙 단독 또는 리보세라닙과 캄렐리주맙의 병용으로 간암 위암 난소암 육종암 등에 대해 10여건의 임상을 진행하고 있다.
HLB는 항서제약이 공들이고 있는 면역관문억제제 캄렐리주맙이 리보세라닙과 병용으로 세계에 진출하기 위해선, 리보세라닙의 글로벌 권리를 갖고 있는 HLB와의 협력이 필수라고 강조했다.
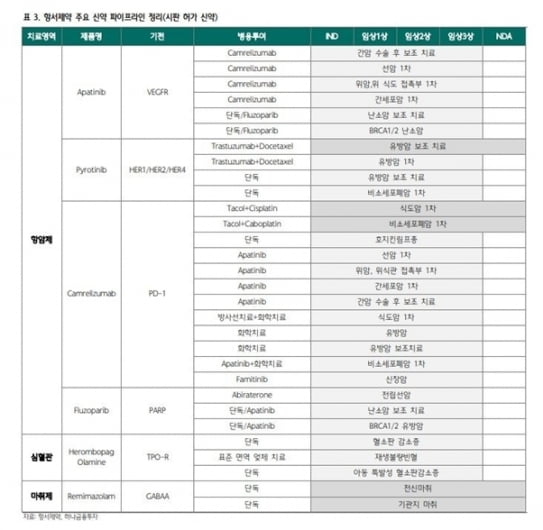
HLB 관계자는 “선양낭성암과 GBM은 2상 단계지만, 결과 분석을 통해 확실한 유효성을 입증할 경우 가속승인(Accelerated Approval)이나 혁신신약(Breakthrough) 지정을 통해 바로 NDA 신청이 가능할 것”이라고 말했다.
김예나 기자 yena@hankyung.com
-
기사 스크랩
-
공유
-
프린트




![물가 지표 초읽기…다시 파월의 시간이 온다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202405/B20231109084118397.jpg)




![[속보] 與 정책위의장에 정점식…원내수석부대표 배준영](https://timg.hankyung.com/t/560x0/data/service/edit_img/202405/38978c85f64995796d4617116d0b7619.jpg)