“뉴지랩파마, 대사항암제 美임상 연내 개시…가능성 입증”
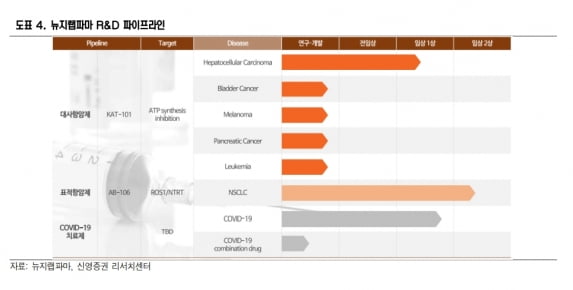
뉴지랩파마의 주요 신약 후보물질(파이프라인)은 대사항암제 ‘KAT-101’, 'ROS1·NTRT' 양성 표적항암제 ‘탈레트렉티닙’, 먹는(경구용) 코로나19 치료제 등이다. 미국 법인과 국내 뉴젠테라퓨틱스가 KAT의 글로벌 개발과 기술도입, 개량신약 연구를 진행하고 있다. 의약품제조및품질관리(GMP) 시설을 보유한 아리제약과 의약품 저온유통 기업 한올티엘을 인수했다.
간암 표적 대사항암제의 미국 임상으로 KAT의 가치를 증명하고 있다는 판단이다. 대사항암제는 암세포의 대사활동을 방해해 암세포가 스스로 사멸하도록 한다.
대사항암제 개발 기업인 미국 애지오스는 2017년 ‘에나시데닙(Idhifa)’에 대해 급성 골수성 백혈병 치료제로 미국 식품의약국(FDA) 승인을 받았다. 작년 1억5400만달러의 매출을 냈다. 이명선 연구원은 “애지오스는 혈액암 중심의 항암제 파이프라인을 보유한 반면, 뉴지랩파마는 고형암을 표적해 임상 성공 시 글로벌 신약개발사로 거듭날 수 있을 것”이라고 기대했다.
KAT-101은 FDA로부터 흑색종과 간암으로 희귀의약품 지정을 받았다. 이 연구원은 “KAT-101은 고형암을 표적으로 경구용과 주사제형으로 개발 중”이라며 “단독요법으로 임상을 시작했으나 병용요법 등 다양한 연구가 가능하다”고 했다.
탈레트렉티닙의 개발도 순항 중이다. 탈레트렉티닙은 미국 안허트로부터 국내에 도입했다. 뉴지랩파마는 젤코리(1세대 ROS1 TKI)를 복용하거나 또는 내성을 가진 비소세포폐암 환자를 대상으로 임상 2상을 신청했다.
이 연구원은 “이미 중국 이노반트가 긍정적인 임상 2상 중간 결과를 발표해 임상 성공 가능성은 높을 것으로 예상한다”며 “동시에 진행되는 일본, 중국, 글로벌 임상을 통해 ROS1에서 ROS1·NTRK 변이 비소세포폐암 환자로 확대할 계획”이라고 설명했다.
뉴지랩파마는 ‘나파모스타트’를 먹는 제형으로 변경한 코로나19 치료제에 대한 임상 1상도 마쳤다. 올해 안에 관련 결과를 발표할 것으로 예상했다.
-
기사 스크랩
-
공유
-
프린트