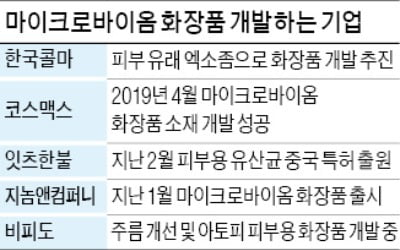
알테오젠 HER2 ADC "캐싸일라보다 고용량서도 안전"
임상 2상 권장용량 4.5mg/kg
4일 알테오젠에 따르면 국내 1상은 HER2 양성 유방암 환자 중 표준치료에 실패한 진행성 또는 재발성 환자를 대상으로 이뤄졌다. 알테오젠의 항체약물접합체(ADC) 후보물질 ALT-P7을 집단(코호트)별로 몸무게 1kg당 0.3mg에서 4.8mg까지 투여했다.
3주 간격으로 ALT-P7을 2회 이상, 12주 이상 투여한 결과 최대내약용량 및 임상 2상 권장용량으로 4.5mg을 도출했다. 4.8mg을 투여한 3명에서 열성호중구감소증 고빌리루빈혈증 근육통 저나트륨혈증 등 용량제한독성이 관찰됐기 때문이다. 또 용량의존적으로 혈중 ALT-P7의 수치가 증가했으며, 면역원성을 보인 환자는 없었다.
유효성에 있어서는 질병관리율(DCR)이 72%로 나타났다. 25명의 환자 중 종양이 커지지 않거나 줄어든 사람이 18명이었다. 권장용량으로 결정된 4.5mg을 투여받은 3명의 무진행생존기간(PFS)은 6.67개월을 기록했다.
알테오젠 관계자는 "임상 1상을 통해 ALT-P7의 최대내약용량 및 안전성과 유효성을 확인했다"며 "로슈의 HER2 ADC 캐싸일라는 3.6mg을 투여하는데, 이보다 고용량에서 안전성을 확인한 점이 긍정적"이라고 말했다.
캐싸일라와 ALT-P7은 비슷한 독소약물을 사용하는데, 투여량이 많을수록 보다 강한 항암효과를 기대할 수 있다는 것이다.
이어 "ALT-P7은 기술수출을 목표로 개발하고 있는 후보물질"이라며 "기술수출에 중점을 두고 개발 전략을 짤 것"이라고 했다. 임상 2상은 위암과 유방암에 대해 기존 면역항암제와의 병용을 고려하고 있다.
ALT-P7은 2018년 미국 식품의약국(FDA)으로부터 위암에 대한 희귀의약품으로 지정받았다.
한민수 기자
-
기사 스크랩
-
공유
-
프린트