美 콘서트 파마, 원형탈모 치료제 3상 성공…내년 허가 신청
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
JAK 억제제, 1·2차 평가지표 충족
HK이노엔 1상 중
HK이노엔 1상 중
콘서트 파마슈티컬스는 1일(현지시간) 원형탈모증 치료제 후보물질 ‘CTP‑543’의 임상 3상에 성공했다고 밝혔다. 1차 효능 평가지표인 치료 24주차에 탈모 심각성 평가 척도(SALT) 20점 이하를 달성한 환자의 비율을 충족하면서다.
CTP-543은 ‘야누스 키나제(JAK)1’ 및 ‘JAK2’를 억제하는 먹는(경구용) 치료제다. 염증을 유발하는 효소 JAK를 억제해 모낭에서 머리카락이 다시 자랄 수 있도록 돕는다. 미국 식품의약국(FDA)으로부터 원형 탈모증 성인 환자의 치료를 위한 혁신 치료제로 지정받았다.
CTP-543의 두 번째 3상(THRIVE-AA2)은 미국 캐나다 유럽에서 중등도에서 중증의 탈모증을 앓고 있는 18~65세 성인 환자 517명을 투약군과 위약군으로 나눠 진행했다. 투약군은 24주 동안 1일 2회 CTP-543 8mg 또는 12mg을 투여받았다.
1차 평가지표인 투여 24주차에 SALT 점수 20점 이하를 달성한 환자의 비율은 12mg 투여군에서 38.3%, 8mg군에서 33.0%였다. 위약군 0.8%에 비해 높았다. 위약군의 환자 비율과 비교해 CTP-543 투여군에 대한 치료 차이가 통계적으로 유의했다. SALT 점수 20점 이하는 전체 두피의 80% 이상에서 모발 재성장이 나타난 것을 의미한다.
2차 평가지표인 24주차에 환자의 만족도 보고결과(SPRO)에 대한 응답자 비율과 12·16·20주에 각각 20점 이하의 절대 SALT 점수를 달성한 환자의 비율도 충족했다. CTP-543 8mg 투여군 47%와 12mg 투여군 52%가 ‘만족’ 또는 ‘매우 만족’했다고 응답했다. 위약군에서 만족한다고 응답한 비율은 2%에 그쳤다.
안전성도 확인했다. 콘서트 파마는 첫 번째 3상 임상시험(THRIVE-AA1)의 결과와 함께 내년 상반기 FDA에 신약허가를 신청할 예정이다.
제임스 카셀라 콘서트 파마 최고개발책임자는 “두 번의 3상을 성공적으로 마침에 따라 내년 상반기에 신약 허가를 신청하고, 가능한 빨리 시장에 출시하기 위해 노력할 것”이라며 “CTP-543이 승인되면 탈모를 앓고 있는 환자를 위한 새로운 치료법이 될 것으로 기대한다”고 말했다.
지난 6월에는 일라이 릴리의 경구용 JAK 억제제 ‘올루미언트’가 원형탈모 치료제로 FDA의 승인을 받았다. FDA가 전신 치료에 활용될 수 있는 원형탈모 치료제를 승인한 건 처음이다. 올루미언트는 2018년 중증 류머티즘 관절염 치료제로도 승인받았다. 국내에서는 종근당이 한국릴리와 공동 판매 계약을 맺고 국내 영업을 맡고 있다.
화이자의 ‘리틀레시티닙’은 지난해 8월 24주간 치료받은 환자의 17~28%가 SALT 20점 이하에 도달했다는 2b·3상 결과를 공개했다. 현재 FDA에 허가를 신청한 상태다.
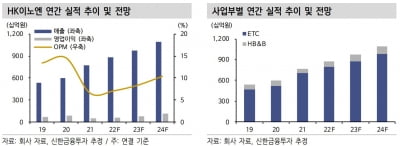
국내에서는 HK이노엔이 JAK1 억제제 후보물질 ‘IN-A002’를 개발 중이다. 성인 30명을 대상으로 국내 1상을 진행하고 있다. 연말 임상을 마칠 것으로 예상하고 있다. HK이노엔은 IN-A002를 류머티즘 관절염, 아토피 피부염과 함께 원형탈모 치료제로 개발할 계획이다.
김예나 기자 yena@hankyung.com
CTP-543은 ‘야누스 키나제(JAK)1’ 및 ‘JAK2’를 억제하는 먹는(경구용) 치료제다. 염증을 유발하는 효소 JAK를 억제해 모낭에서 머리카락이 다시 자랄 수 있도록 돕는다. 미국 식품의약국(FDA)으로부터 원형 탈모증 성인 환자의 치료를 위한 혁신 치료제로 지정받았다.
CTP-543의 두 번째 3상(THRIVE-AA2)은 미국 캐나다 유럽에서 중등도에서 중증의 탈모증을 앓고 있는 18~65세 성인 환자 517명을 투약군과 위약군으로 나눠 진행했다. 투약군은 24주 동안 1일 2회 CTP-543 8mg 또는 12mg을 투여받았다.
1차 평가지표인 투여 24주차에 SALT 점수 20점 이하를 달성한 환자의 비율은 12mg 투여군에서 38.3%, 8mg군에서 33.0%였다. 위약군 0.8%에 비해 높았다. 위약군의 환자 비율과 비교해 CTP-543 투여군에 대한 치료 차이가 통계적으로 유의했다. SALT 점수 20점 이하는 전체 두피의 80% 이상에서 모발 재성장이 나타난 것을 의미한다.
2차 평가지표인 24주차에 환자의 만족도 보고결과(SPRO)에 대한 응답자 비율과 12·16·20주에 각각 20점 이하의 절대 SALT 점수를 달성한 환자의 비율도 충족했다. CTP-543 8mg 투여군 47%와 12mg 투여군 52%가 ‘만족’ 또는 ‘매우 만족’했다고 응답했다. 위약군에서 만족한다고 응답한 비율은 2%에 그쳤다.
안전성도 확인했다. 콘서트 파마는 첫 번째 3상 임상시험(THRIVE-AA1)의 결과와 함께 내년 상반기 FDA에 신약허가를 신청할 예정이다.
제임스 카셀라 콘서트 파마 최고개발책임자는 “두 번의 3상을 성공적으로 마침에 따라 내년 상반기에 신약 허가를 신청하고, 가능한 빨리 시장에 출시하기 위해 노력할 것”이라며 “CTP-543이 승인되면 탈모를 앓고 있는 환자를 위한 새로운 치료법이 될 것으로 기대한다”고 말했다.
지난 6월에는 일라이 릴리의 경구용 JAK 억제제 ‘올루미언트’가 원형탈모 치료제로 FDA의 승인을 받았다. FDA가 전신 치료에 활용될 수 있는 원형탈모 치료제를 승인한 건 처음이다. 올루미언트는 2018년 중증 류머티즘 관절염 치료제로도 승인받았다. 국내에서는 종근당이 한국릴리와 공동 판매 계약을 맺고 국내 영업을 맡고 있다.
화이자의 ‘리틀레시티닙’은 지난해 8월 24주간 치료받은 환자의 17~28%가 SALT 20점 이하에 도달했다는 2b·3상 결과를 공개했다. 현재 FDA에 허가를 신청한 상태다.
국내에서는 HK이노엔이 JAK1 억제제 후보물질 ‘IN-A002’를 개발 중이다. 성인 30명을 대상으로 국내 1상을 진행하고 있다. 연말 임상을 마칠 것으로 예상하고 있다. HK이노엔은 IN-A002를 류머티즘 관절염, 아토피 피부염과 함께 원형탈모 치료제로 개발할 계획이다.
김예나 기자 yena@hankyung.com
ADVERTISEMENT
ADVERTISEMENT




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


