'바벤시오 병용 고형암 임상 조기 종료' 지놈앤컴퍼니 "선택과 집중"
지놈앤컴퍼니는 6일 "마이크로바이옴 면역항암 치료제(GEN-001)로 진행하던 고형암 대상 병용 임상 1/1b상(STUDY101)을 조기 종료한다"고 밝혔다.
지놈앤컴퍼니는 2020년 4월 미국 식품의약국(FDA), 그해 11월 국내 식품의약품안전처로부터 GEN-001을 독일 머크·미국 화이자의 면역항암제 바벤시오(성분명 아벨루맙)와 병용 투여하는 임상 1/1b상 계획을 승인받은 바 있다.
적응증은 비소세포폐암, 두경부암, 요로상피암 등 세 가지 고형암이었다. 임상 1상은 9명, 임상 1b상은 각 암종별로 18명씩 총 54명에 대해 임상을 진행할 계획이었다.
현재 임상 1상까지 마치고 임상 2상 권장용량(RP2D)까지 확정한 상태다. 지놈앤컴퍼니는 "선택과 집중 차원에서 병용 임상 전략을 수정했다"고 했다.
회사 측은 바벤시오와의 병용 임상 축소는 독일 머크, 미국 화이자와 충분히 논의한 결과라고 했다.
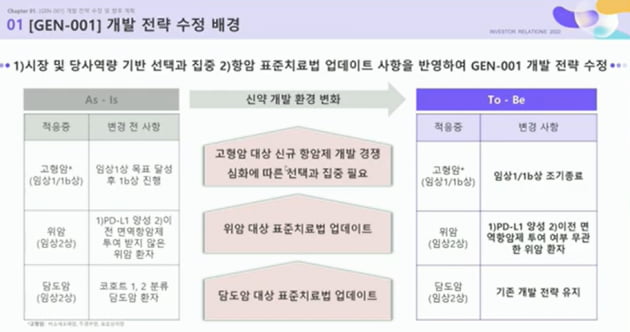
고형암 대상 임상을 조기 중단하고, 위암 임상 2상에 집중하겠다는 게 회사 측 설명이다.
위암 병용 임상 2상은 총 38명을 대상으로 설계됐는데 현재 20명까지 환자 등록이 마무리됐다. 지놈앤컴퍼니 관계자는 "내년 상반기 20명에 대한 중간 데이터를 발표할 예정"이라고 했다.
위암 임상 설계는 일부 수정했다. 기존 PD-L1 양성이고 면역항암제를 투여 받지 않은 환자 대상이었던 데서, PD-L1 양성이면서 이전 면역항암제 투여 여부와 무관하게 환자를 모집하기로 했다.
서영진 지놈앤컴퍼니 대표는 "위암 1차 표준치료제 시장 상황이 업데이트됐기 때문"이라고 했다.
지놈앤컴퍼니는 여기에 MSD의 키트루다(펨브롤리주맙)와 GEN-001으로 담도암 대상 임상 2상(STUDY202)도 진행 중이다.
임상시험계획(IND) 승인은 받았고, 내년 초 환자 등록을 시작해 연말 중간 데이터를 공개할 계획이다.
면역항암제를 투여 받은 적이 있는 환자와 그렇지 않은 환자 2개 코호트로 구분한 기존 임상 전략도 그대로 유지하기로 했다.
이로써 지놈앤컴퍼니의 마이크로바이옴 면역항암제 병용 임상은 2개 파이프라인으로 압축됐다.
한재영 기자 jyhan@hankyung.com
-
기사 스크랩
-
공유
-
프린트












![[오늘의 arte] 예술인 QUIZ : 그의 그림 속 인물은 설명되지 않는다](https://timg.hankyung.com/t/560x0/photo/202405/AA.36699526.3.jpg)