삼성 스텔라라 시밀러 유럽 허가 임박
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
유럽의약품청 자문위 허가 권고
글로벌 14兆 시장 유리한 고지
글로벌 14兆 시장 유리한 고지
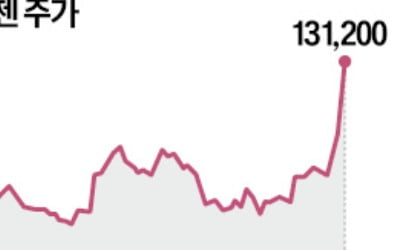
자가면역질환 치료제 스텔라라의 바이오시밀러가 유럽 판매 허가를 앞두고 있다.
삼성바이오에피스는 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)가 스텔라라 바이오시밀러인 피즈치바(SB17)의 판매허가에 대해 긍정 의견을 냈다고 25일 밝혔다.
CHMP가 긍정 의견을 내면 유럽연합 집행위원회(EC)는 최종 검토를 거쳐 통상 2~3개월 뒤 정식 허가한다. 스텔라라는 글로벌 제약사 얀센이 개발한 판상 건선, 건선성 관절염, 크론병 등의 자가면역질환 치료제다. 연간 글로벌 매출은 약 14조원에 이른다.
삼성바이오에피스는 정식 허가가 나오면 오는 7월께 피즈치바를 유럽에 출시할 것으로 알려졌다. 유럽에서 스텔라라 바이오시밀러 판매허가를 받은 곳은 아이슬란드 제약사 알보텍이 유일하다. 셀트리온과 동아에스티는 지난해 5월과 6월 각각 판매허가를 신청했다.
삼성바이오에피스 관계자는 “피즈치바의 유럽 시장 판매는 글로벌 제약사 노바티스의 자회사 산도스가 맡는다”며 “스텔라라의 유럽 물질특허가 만료되는 7월 이후 출시를 계획하고 있다”고 말했다.
이영애 기자 0ae@hankyung.com
삼성바이오에피스는 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)가 스텔라라 바이오시밀러인 피즈치바(SB17)의 판매허가에 대해 긍정 의견을 냈다고 25일 밝혔다.
CHMP가 긍정 의견을 내면 유럽연합 집행위원회(EC)는 최종 검토를 거쳐 통상 2~3개월 뒤 정식 허가한다. 스텔라라는 글로벌 제약사 얀센이 개발한 판상 건선, 건선성 관절염, 크론병 등의 자가면역질환 치료제다. 연간 글로벌 매출은 약 14조원에 이른다.
삼성바이오에피스는 정식 허가가 나오면 오는 7월께 피즈치바를 유럽에 출시할 것으로 알려졌다. 유럽에서 스텔라라 바이오시밀러 판매허가를 받은 곳은 아이슬란드 제약사 알보텍이 유일하다. 셀트리온과 동아에스티는 지난해 5월과 6월 각각 판매허가를 신청했다.
삼성바이오에피스 관계자는 “피즈치바의 유럽 시장 판매는 글로벌 제약사 노바티스의 자회사 산도스가 맡는다”며 “스텔라라의 유럽 물질특허가 만료되는 7월 이후 출시를 계획하고 있다”고 말했다.
이영애 기자 0ae@hankyung.com
ADVERTISEMENT
ADVERTISEMENT





![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


