지아이이노베이션, ‘GI-101’ 1·2상 변경 신청…신규 공정 도입
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
지아이이노베이션은 국내 식품의약품안전처에 지난 7일 GI-101의 임상 1·2상의 임상시험계획 변경을 신청했다.
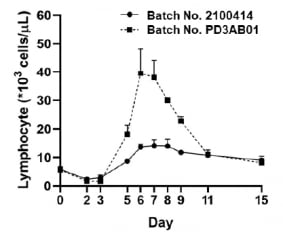
GI-101은 CD80과 인터루킨2(IL-2) 변이체의 이중융합 단백질이다. 진행 중인 GI-101 단독요법 임상 1·2상에서 완전관해(CR) 및 부분관해(PR)이 각각 1건씩 관찰됐다.
지아이이노베이션은 신규 제조 공정으로 만든 GI-101을 원숭이 모델에 투여한 결과 항암면역세포 수가 기존 제조 공정의 GI-101을 투여했을 때보다 대비 늘어난 것을 확인했다.
이에 우수한 항암 효과를 위해 신규 제조 공정을 임상시험에 도입하기로 결정했다. 서울아산병원 세브란스병원 등 주요 임상 교수 및 공동 임상을 진행 중인 글로벌 제약사도 임상 설계 변경에 동의했다. 미국 식품의약국(FDA)과도 회의를 진행해 신규 공정 도입 및 임상 설계 변경에 대한 동의를 받았다고 회사는 전했다.
장명호 지아이이노베이션 임상총괄사장은 “원숭이 투여 시 기존 GI-101이 면역세포를 약 2~3배 증식시켰다면, 신규 공정으로 생산한 GI-101은 독성 없이 혈중에서 7배의 림프구 증가가 관찰됐다”며 “강력한 항암 활성이 예상되는 신규 공정의 GI-101로 많은 암 환자들에게 희망을 드리겠다”고 말했다.
박인혁 기자 hyuk@hankyung.com
-
기사 스크랩
-
공유
-
프린트






![[단독] 새마을금고 '초비상'…124곳에 '부실 딱지'](https://timg.hankyung.com/t/560x0/photo/202406/AA.37001326.3.jpg)




![[오늘의 arte] 티켓 이벤트 : 뮌헨 체임버 오케스트라](https://timg.hankyung.com/t/560x0/photo/202406/AA.37010608.3.jpg)