식약처, 휴마시스·SD바이오센서 자가진단키트 조건부 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
항원방식 자가진단키트 2개 제품
국내 첫 번째 품목 허가
국내 첫 번째 품목 허가
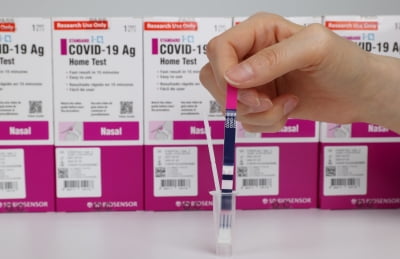
국내에서도 일시적으로 코로나19 자가진단키트의 사용이 가능해질 전망이다. 식품의약품안전처는 휴마시스와 SD바이오센서의 코로나19 자가진단키트 2개 제품에 대해 조건부 품목 허가를 했다고 23일 밝혔다. 3개월 내 자가검사에 대한 임상적 성능시험 추가 자료를 제출하는 조건이다.
이 제품들은 이미 국내에서 전문가용으로 허가를 받았고, 해외에서 자가검사용 임상시험을 실시해 긴급사용승인을 받았다. 앞서 식약처는 일반인용 자가진단키트가 개발될 때까지 이 같은 제품에 한해 조건부 허가하겠다는 방침을 밝힌 바 있다.
휴마시스와 SD바이오센서는 그동안 유럽을 대상으로 자가진단키트를 수출해왔다. 휴마시스의 제품은 체코 덴마크 오스트리아 등 3개국에서 자가진단용으로 사용되고 있다. SD바이오센서는 독일 네덜란드 덴마크 등 유럽 7개국에 자가진단키트를 수출 중이다.
이번 국내 조건부 승인으로 휴마시스와 SD바이오센서는 3개월 간 국내에서 일반인을 대상으로 자가진단키트 임상을 진행해 자료를 식약처에 제출해야 한다.
자가진단키트는 일반인이 스스로 검체를 채취해 코로나19 감염 여부를 확인할 수 있다. 비강 도말 검체에서 바이러스의 항원을 검출해 검사하는 방식이다. 15분 내외로 결과를 확인할 수 있다.
다만 기존 유전자 증폭(PCR) 방식이나 의료인 및 전문가가 콧속 깊은 비인두에서 검체를 채취해 수행하는 항원 방식에 비해 민감도(음성 확인율)가 낮다는 단점이 있다는 설명이다.
식약처 관계자는 “자가진단키트는 개인이 손쉽게 자가검사를 할 수 있는 보조적인 수단으로, 이번 조건부 허가 제품은 정식허가 제품이 나오기 이전에 한시적으로 사용하는 제품”이라며 “조건부 허가 제품을 대체할 정식허가 제품의 신속 개발·허가를 적극적으로 지원해 국민들이 충분한 진단‧치료 기회를 보장받을 수 있도록 할 것”이라고 말했다.
김예나 기자 yena@hankyung.com
이 제품들은 이미 국내에서 전문가용으로 허가를 받았고, 해외에서 자가검사용 임상시험을 실시해 긴급사용승인을 받았다. 앞서 식약처는 일반인용 자가진단키트가 개발될 때까지 이 같은 제품에 한해 조건부 허가하겠다는 방침을 밝힌 바 있다.
휴마시스와 SD바이오센서는 그동안 유럽을 대상으로 자가진단키트를 수출해왔다. 휴마시스의 제품은 체코 덴마크 오스트리아 등 3개국에서 자가진단용으로 사용되고 있다. SD바이오센서는 독일 네덜란드 덴마크 등 유럽 7개국에 자가진단키트를 수출 중이다.
이번 국내 조건부 승인으로 휴마시스와 SD바이오센서는 3개월 간 국내에서 일반인을 대상으로 자가진단키트 임상을 진행해 자료를 식약처에 제출해야 한다.
자가진단키트는 일반인이 스스로 검체를 채취해 코로나19 감염 여부를 확인할 수 있다. 비강 도말 검체에서 바이러스의 항원을 검출해 검사하는 방식이다. 15분 내외로 결과를 확인할 수 있다.
다만 기존 유전자 증폭(PCR) 방식이나 의료인 및 전문가가 콧속 깊은 비인두에서 검체를 채취해 수행하는 항원 방식에 비해 민감도(음성 확인율)가 낮다는 단점이 있다는 설명이다.
식약처 관계자는 “자가진단키트는 개인이 손쉽게 자가검사를 할 수 있는 보조적인 수단으로, 이번 조건부 허가 제품은 정식허가 제품이 나오기 이전에 한시적으로 사용하는 제품”이라며 “조건부 허가 제품을 대체할 정식허가 제품의 신속 개발·허가를 적극적으로 지원해 국민들이 충분한 진단‧치료 기회를 보장받을 수 있도록 할 것”이라고 말했다.
김예나 기자 yena@hankyung.com
ADVERTISEMENT
ADVERTISEMENT





![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


