앱클론 “세계 최초 ‘zCAR-T’ 전임상 연내 완료 목표”

앱클론이 차별화된 CAR-T 치료제를 개발할 수 있었던 건 회사의 플랫폼 기술 덕분이다. ‘네스트(NEST)’는 암세포의 새로운 결합부위(에피토프)에 붙는 항체를 찾아준다. 에피토프가 달라지면 이를 기반으로 만들어진 의약품의 효능도 달라진다는 게 이 대표의 설명이다. 네스트를 이용하면 기존에 블록버스터(글로벌 연매출 1조원 이상의 의약품)가 존재하는 질환에 대해서도 새로운 항체로 승부를 볼 수 있다고 덧붙였다.
앱클론은 네스트 기술을 기반으로 위암과 유방암, 대장암 등 고형암과 류머티즘 관절염 등 자가면역질환 치료제 후보물질을 보유하고 있다. 2016년 스웨덴의 앨리게이터 바이오사이언스 및 유한양행과 네스트 기술 기반의 항체신약 공동개발 계약을 체결했다.
위암 및 유방암 치료제 ‘AC101’은 중국 상하이 헨리우스 바이오텍에 기술이전됐다. 헨리우스는 작년 9월 위암 환자 150명을 대상으로 하는 AC101 중국 2상을 시작했다. 허셉틴 또는 허셉틴 바이오시밀러(바이오의약품 복제약)와 AC101의 병용투여 임상이다. 헨리우스는 마지막 환자 방문일(LSLV)을 내년 4월로 예상하고 있다.
AC101은 허셉틴과 같이 ‘HER2’ 단백질을 표적한다. 하지만 허셉틴과 180도 반대편의 HER2 에피토프에 결합해 허셉틴과 병용투여 시 마치 두 손으로 목을 조르듯 암세포에 작용해 효과가 증폭될 것으로 보고 있다.
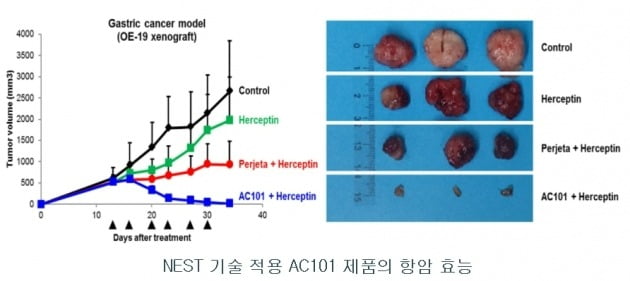
AC101은 앞서 허셉틴과의 병용투여로 진행한 위암과 유방암 대상 전임상 동물실험에서도 효과를 확인했다. 위암 모델에서 투여 30일째 대조군(허셉틴과 퍼제타 병용투여)에 암세포가 남아있던 것과 달리, 허셉틴·AC101 병용투여군에서는 거의 사라졌다는 설명이다.
zCAR-T로 CRS 부작용 억제 기대
앱클론은 이중항체 개발 플랫폼인 ‘어피맵(AffiMab)’도 갖고 있다. 어피맵은 ‘어피바디’를 활용한다. 어피바디는 6kDa(킬로달톤) 크기로 일반 항체의 25분의 1 수준인 작은 단백질이다. 어피바디에 두 개의 항체를 붙여 각각 다른 항원 단백질을 표적하는 이중항체를 만드는 것이다. 표적하는 항원 단백질을 달리하면 다양한 질환에 활용할 수 있을 것으로 기대 중이다.대부분의 질병은 한 개 이상의 질환 단백질이 관여해 생긴다. 때문에 두 개의 질환 단백질에 동시에 작용해 상승(시너지) 효과를 기대할 수 있을 것으로 보고 있다.
앱클론은 이 어피바디를 이용해 세계 최초로 ‘스위처블 CAR-T 치료제(zCAR-T)’도 개발 중이다. 키메릭항원수용체 T세포(CAR-T)의 활성을 조절하는 ‘스위치 물질’을 추가한 형태다. 스위치 물질은 어피바디에 ‘코티닌’과 표적 항체를 붙인 것이다. 코티닌은 zCAR-T와 결합해 활성을 조절한다. 활성화된 zCAR-T는 특정 질환 단백질을 표적하는 어피바디에 의해 암세포에 붙어 항암 효과를 낸다.
zCAR-T의 CAR는 코티닌에만 결합하도록 설계됐다. 코티닌은 니코틴의 대사산물로, 체내에 존재하지 않는다. 때문에 zCAR-T는 체내에 주입돼도 항암 작용을 하지 않는다. 코티닌이 포함된 스위치 물질을 넣어줘야 활동을 시작한다.
스위치 물질을 통해 zCAR-T의 활성을 조절할 수 있어, 기존 CAR-T 치료제의 과도한 면역반응 부작용인 사이토카인 폭풍 증후군(CRS)에서 자유로울 것이란 예상이다.
앱클론의 첫 zCAR-T 후보물질(파이프라인)인 ‘AT501’은 ‘HER2’ 수용체를 표적하는 어피바디를 통해 난소암 치료제로 개발 중이다. 현재 전임상 중이다. 올해 완료가 목표다. 쥐(마우스) 대상 동물실험에서 투여 14일째에 암세포가 완전관해됐다는 설명이다.
이중항체 치료제 개발도 순항 중
어피맵 기반 류머티즘 관절염 치료제인 ‘AM201’과 대장암 치료제 ‘AM105’의 전임상도 순항 중이라고 했다.류머티즘 관절염을 일으키는 대표적인 물질로는 ‘종양괴사인자 알파(TNF-α)’와 ‘인터루킨6(IL-6)’가 알려져 있다. AM201은 TNF-α와 IL-6을 동시에 억제한다. 현재 진행 중인 전임상 동물실험에서 AM201 투여 시, 류머티즘 관절염 생체표지자(바이오마커)로 활용되는 혈청아밀로이드A(SAA) 단백질 증가 억제 효과가 대조군(휴미라)보다 10배 낮은 농도에서도 대조군 대비 높았다.
AM105는 현재 전임상 결과 확보 중이다. AM105는 T세포 활성화를 촉진하는 ‘CD137’과 대장암세포의 ‘EGFR’ 단백질에 동시에 결합하는 면역항암제 후보물질이다. EGFR이 과발현되는 암세포에 특이적으로 결합해 T세포의 활성화를 유도한다. 향후에는 EGFR 외에도 ‘메소텔린(MSLN)’, ‘HER2’ 등 또 다른 질환 단백질을 표적하는 치료제로도 발전시킨다는 계획이다. AM105의 이 같은 확장성에 몇몇 기업이 관심을 보이고 있다고도 했다.
이 대표는 2022년이 앱클론의 입지를 한 단계 올릴 수 있는 중요한 해가 될 것으로 보고 있다. 그는 “올해 기술이전 등으로 작년 대비 약 30% 증가한 40억원 매출을 목표하고 있다”며 “CAR-T 치료제나 이중항체로 올해 좋은 성과를 보여드리겠다”고 말했다.
이도희 기자
-
기사 스크랩
-
공유
-
프린트




!["심각한 고평가"…AI 서버 수요 의심 커졌다 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202406/B20240601065547707.jpg)