"하한가 치길래 '줍줍' 했는데…망한 건가요" 초조한 개미들 [한경우의 케이스스터디]
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
HLB 연속 하한가 이후 매물대 박스권에 갇힌 주가
희망적인 CRL 해석에 장중 16% 올랐다가 하락전환
희망적인 CRL 해석에 장중 16% 올랐다가 하락전환

HLB는 각종 소식과 루머 속에 하루에도 몇번씩 주가가 출렁이고 있습니다. 하지만 아직 뚜렷하게 호재와 악재를 가를만한 소식은 없어 보입니다. HLB 주주들은 반토막난 주식을 계속 들고 있어도 되는 걸까요.

2거래일 연속 하한가 이후 완만한 반등…쌓여가는 매물대
25일 한국거래소에 따르면 전날 HLB는 4.11% 오른 5만700원에 마감됐습니다. 시가총액은 6조6339억원으로 코스닥 4위를 기록했습니다.미국에서의 신약 승인 불발 소식이 전해지기 직전인 16일 종가(9만5800원) 기준으로는 시가총액이 12조원을 넘었습니다. 당시와 비교하면 47.08% 하락한 상태입니다. 2거래일 연속 하한가를 기록한 뒤 7.87% 반등하는 데 그쳤습니다.
반등폭이 시원치 않은 건 주주들에게 나쁜 소식입니다. 제아무리 반등 시기가 온다고 하더라도 주가 상승이 시원치 않을 수 있습니다. 발목을 잡는 물량이 많이 때문입니다. HLB의 200거래일 차트를 보면 약 4만7200원~5만6100원 매물대에 쌓인 물량이 1억1902만주(25.15%)입니다.
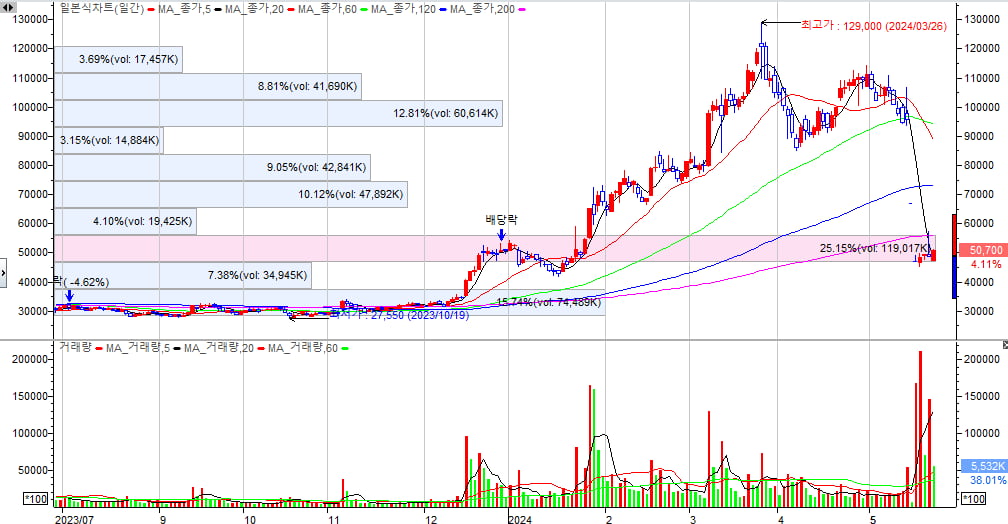
문제는 23일에 HLB 주식을 매수한 투자자입니다. 장중 주가가 16.43%나 급등했지만, 상승분을 모두 반납하고 하락전환해 마감됐습니다. 거래량이 1455만6424주로, 적지 않습니다. 장중 급등을 본격적 반등의 초입으로 보고 뛰어든 투자자라면 큰 손실을 떠안고 있을 겁니다. 보통 이런 투자자들은 본전만 회복하면 보유한 주식을 모두 팔아치우는 경우가 많습니다. 호재로 매수세가 유입돼도 이를 상쇄할 매도 물량이 대기하고 있을 가능성이 큽니다.
“약효·안전성 관련 지적 없었다” 해명에 장중 16% 치솟았지만…
매물대를 돌파하기 위해서는 큰 호재가 필요합니다. HLB의 경우 이번에 승인이 불발된 리보세라닙·캄렐리주맙에 대한 미국 식품의약국(FDA) 승인 가능성을 확신할 만한 이벤트가 생긴다면 매물대를 돌파할 가능성이 큽니다.앞서 HLB는 지난 17일 개장 전 미 FDA로부터 리보세라닙·캄렐리주맙 병용요법의 시판승인 신청에 대한 보완요구서한(CRL)을 받았다고 밝힌 바 있습니다. 이 악재를 뒤집을 만한 호재가 필요하다는 판단에 발표를 한 겁니다.
이러한 발표는 23일 장중 나타난 급등의 이유이기도 합니다. HLB가 서울 송파구 소피텔엠베서더에서 포럼을 개최해 CRL의 내용을 설명하며 FDA가 요구한 보완 사항이 심각하지 않아, 신약 승인이 몇 달 안에 이뤄질 수 있다는 뉘앙스를 풍겼습니다.

리보세라닙·캄렐리주맙 병용요법의 약효·안전성에 대한 지적이 없었고, 리보세라닙과 관련해서는 어떤 이슈도 제기되지 않았다는 겁니다.
HLB·항서제약도 아직 구체적 지적사항 파악 못해
급등했던 주가가 하락전환한 이유가 있었습니다. 아직 승인 불발의 이유를 HLB와 항서제약도 구체적으로 알지 못하고 있다는 불확실성이 그겁니다. ‘캄렐리주맙 생산시설의 미비점이 구체적인 무엇인지 서면으로 질의하면서 FDA에 미팅을 신청했다’는 게 24일 현재까지 확정된 사실입니다.BIMO 실사 미완료 문제는 더 심각합니다. 어떤 임상기관을 실사하지 못했는지도 확실히 알지 못하고, 안다고 해도 HLB와 항서제약이 할 수 있는 게 없습니다. FDA가 실사에 나서줘야 합니다. HLB·항서제약은 FDA가 실사하지 못한 임상기관을 전쟁 중인 우크라이나와 러시아에 있는 곳들로 추정하고 있습니다. 실사 미완료 사유가 ‘여행 제한’으로 기재됐기 때문입니다.
물론 실사를 완료하지 않고 신약으로 승인된 사례는 있습니다. FDA가 실사를 핑계로 리보세라닙·캄렐리주맙의 승인을 계속 지연시킬 수도 있습니다. FDA 신약 승인 절차에 정통한 업계 관계자는 “(신약 심사 과정에서) 임상 사이트(기관) 실사는 매우 중요하다”고 말했습니다.
한경우 한경닷컴 기자 case@hankyung.com




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


