노바티스·머크도 해결 못한 폐암치료제 부작용 개선 나선 에이비온
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
미국 국제암학회서 임상2상 데이터에 호평 쏟아져
아스트라제네카 놓친 6조원 C-Met 시장에 도전장
"빅파마와 기술수출 협의중…내년 마일스톤 수천억 자신"
아스트라제네카 놓친 6조원 C-Met 시장에 도전장
"빅파마와 기술수출 협의중…내년 마일스톤 수천억 자신"

"폐암 환자 중에선 고령이 많은데 안전성이 높다는 점에서 상당히 인상적입니다."(독일 퀼른대 교수)
지난달 미국 보스턴에서 열린 국제암학회에선 한국의 한 바이오기업이 개발한 폐암 신약 후보물질에 대한 호평이 이어졌다. 시판중인 기존 약물에서 손과 발이 붓는 부종 등 부작용을 크게 개선했기 때문이다. 모두 경쟁 약물의 임상을 담당했던 의사로부터 나온 평가여서 더 의미가 크다는 분석이다.
신약개발 코스닥 상장사인 에이비온은 지난달 미국암학회(AACR), 미국국립암연구소(NCI), 유럽암학회(EORTC)가 공동 주최하는 국제암학회 ‘AACR-NCI-EORTC’에서 폐암 치료 후보물질 ‘ABN401(바바매킵,Vabametkib)’의 글로벌 임상 2상 중간 결과를 발표했다.
기존 폐암약에 잘 반응하지 않고 암을 더욱 악화시키는 유전자 돌연변이(C-Met)를 표적해 치료하는 이 물질은 글로벌 임상 2상에서 경쟁 약물 대비 높은 안전성을 보여 주목을 끌었다.
신영기 에이비온 대표(사진)는 한국경제신문과의 인터뷰에서 "이번 학회를 통해 바바매킵이 기존 약물 대비 우수한 약효를 보이면서도 부작용이 거의 없는 '계열내 최고의 약물(Best-in-class)'로 인정을 받았다"며 "전세계에 경쟁자가 없다"고 말했다.
바바매킵은 전체 암환자 중 사망률이 높은 폐암, 그 중에서도 기존 약물로도 고쳐지지 않는 C-Met 돌연변이 비소세포폐암의 표적치료제다.
폐암은 암세포 크기에 따라 소(小)세포폐암과 비소(非小)세포폐암으로 나뉜다. 평균 생존기간은 비소세포폐암은 4~5년, 소세포폐암은 1년에 불과하다. 폐암 환자의 80%는 비소세포폐암을 앓는다.
매년 비소세포폐암 환자 170만명이 발생하고 있지만 이중 3%인 5만명은 대표적인 폐암치료제인 아스트라제네카의 타그리소가 전혀 듣지 않는 환자다. 타그리소가 표적한 EGFR(상피세포 성장인자 수용체) 돌연변이가 아닌 간세포 성장인자 수용체(C-Met) 유전자 변이(MET 엑손 14 결실)로 발생하기 때문이다.
또 EGFR변이로 진단받아 타그리소로 치료를 받다가도 C-Met 돌연변이로 바뀌면서 약에 내성이 생긴 환자도 연 20만명씩 발생하고 있다.
에이비온은 타그리소가 전혀 듣지 않는 C-Met 돌연변이 비소세포폐암 환자 25만명을 대상으로 바바매킵을 개발했다. 이 치료제 시장은 약 6조 6000억원 규모로 매년 23.9%씩 성장하고 있다.
분자병리학자로 서울대 약대 교수이기도 한 신 대표는 C-Met 변이에 대해 "EGFR은 주로 폐암만 일으키지만 C-Met은 유방암, 신장암, 간암 등 다양한 암에서 발견되는 돌연변이"라며 "모든 암을 더욱 악화시키는 악랄한 유전자 변이"라고 설명했다.
또 모든 암 환자가 사망직전에 C-Met이 많이 나오고 기존 약물로는 치료가 불가능하다는 설명이다. 그는 "이 때문에 C-Met을 타깃으로 한 물질은 EGFR을 타깃으로 한 것보다 더 궁극적이면서 여러 적응증으로 확장이 가능한 치료제"라고 강조했다.
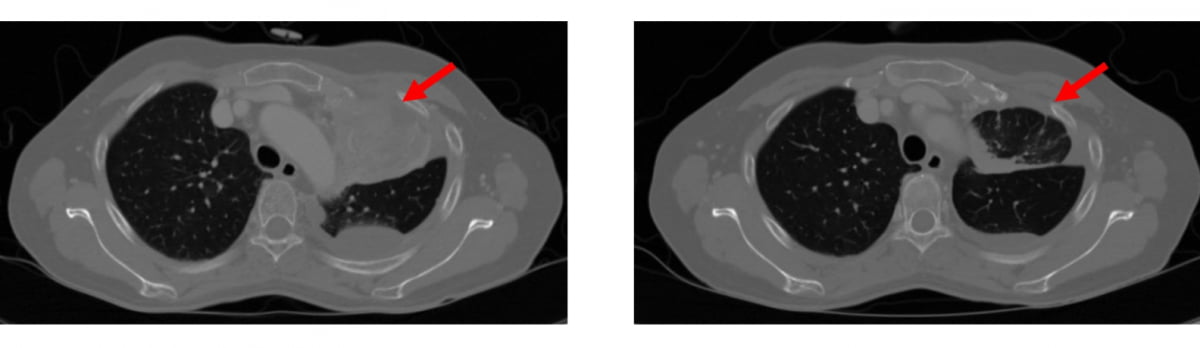
‘AACR-NCI-EORTC’에서 에이비온가 발표한 임상 2상 중간데이터에 따르면 치료 경험이 없는 환자 중 바바매킵 투입 환자의 75%는 암세포의 크기가 30% 이상 줄어드는 부분관해를 보였다. 경쟁 약물은 60%대였다.
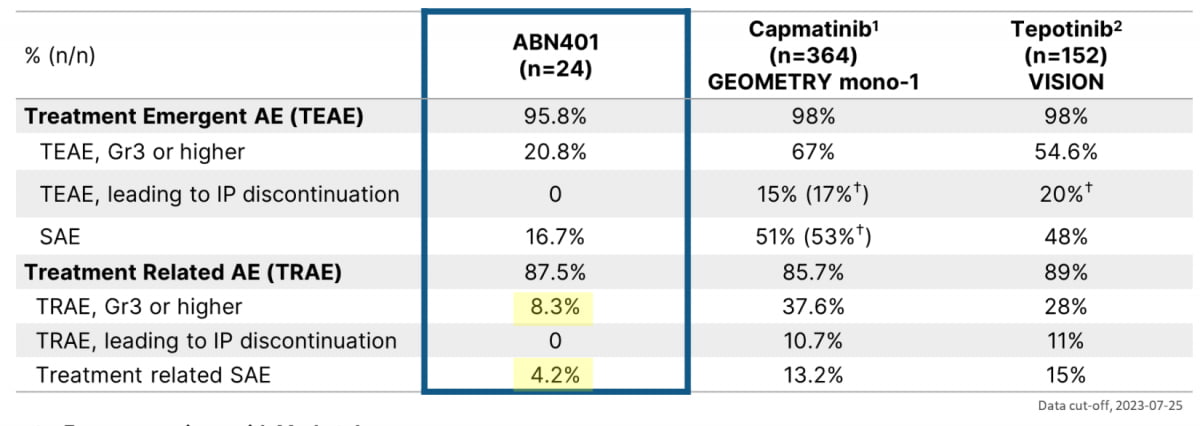
특히 손과 발이 붓거나(사지말단 부종) 손톱과 발톱이 빠지는 등 입원해야 할 정도의 심각한 부작용(3등급 이상)이 나온 비율은 8.3%로 노바티스의 타브렉타(37%), 머크의 템메코(28%) 등과 큰 차이를 보였다. 부작용으로 인한 약물중단비율 역시 0%로 노바티스(10%), 머크(11%) 등에 비해 크게 개선됐다. 신 대표는 "안전성이 높은 약물로 인정받아 기존 타그리소와 병용 처방도 가능할 것"이라고 했다.
아울러 기술수출도 추진 중이다. 신 대표는 "현재 복수의 글로벌 대형제약사와 기술 수출을 협의중"이라며 "총 기술 수출 규모는 조단위일 것"이라고 자신했다.
그는 "기술수출이 이뤄질 경우 선급금(업프론트)만 600억~1000억원, 선급금 이후에도 내년부터 수천억원의 마일스톤(단계별 기술료) 매출을 기대할 수 있다"고 말했다.
실제 C-Met 타깃 기술은 시장에서 높은 평가를 받고 있다. 미국 대형 제약사 BMS는 작년 6월 터닝포인트라는 벤처기업을 5조3000억원에 인수했다. 신 대표는 기술수출에 대해 "60캐럿짜리 다이아몬드를 파는 것과 같다"며 "이 기술의 진가를 알아볼 매수처도, 이 기술을 발전시킬 역량도 글로벌 10대 제약사뿐"이라고 강조했다. 그러면서 "바바매킵은 여러 국책과제로 선정되며 정부 지원을 받아 개발된 것이라 수출이 성사된다면 더 큰 의미가 있다"고도 했다.
에이비온은 이밖에 바이러스성 호흡기 질환 치료제(ABN101), 클라우딘3 발현 암 치료제(ABN501)도 개발 중이다. 장기적인 비전에 대해 신 대표는 "바바매킵 등 동급 최고의 약물(Best-in-class)뿐만 아니라 누구도 개발하지 못한 계열내 최초 약물(First-in-class)을 만들고 싶다"고 말했다.
안대규 기자 powerzanic@hankyung.com
**이 기사는 2023년 11월 6일 11시 25분 <한경 바이오인사이트> 온라인에 게재됐습니다.



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


