미국 식품의약국(FDA)으로부터 정식 승인받은 아두헬름이 보험 적용 거부 등 어려움에 처한 까닭은 효능과 안전성 모두에서 검증이 부족하다는 업계의 인식 때문이다. 아두헬름의 대표적인 부작용은 아밀로에드베타 관련 영상 이상(ARIA)으로 뇌내 미세 출혈 및 부종 등이 나타나는 현상이다. 최소 4명 이상 환자가 아두헬름의 부작용으로 사망했다.
효능에 대해서도 풀어야 할 숙제가 많다. FDA의 승인 당시에도 아두헬름이 약의 효능을 평가하는 평가지표(endpoint) 대신 대리 충족점(surrogate endpoint)을 인정해 판매를 허가해 많은 잡음이 생겼다. 바이오젠의 차기 알츠하이머병 후보물질 레카네맙 또한 효능 면에선 여전히 검증이 필요하지만 안전성 면에서는 아두헬름 대비 낫다는 평가를 받고 있다.
레카네맙은 어떤 약
레카네맙은 아두헬름과 마찬가지로 뇌 속에서 생성되고 엉겨 응집체(플라크)를 만드는 아밀로이드베타 단백질과 결합하는 항체 의약품이다. 아밀로이드베타 단백질과 결합한 뒤 면역세포에게 아밀로이드베타 단백질을 제시해 제거하는 원리로 작동한다. 에자이와 레카네맙을 공동개발한 스웨덴 바이오기업 바이오아크틱에 따르면 레카네맙은 아두헬름과 비교해 섬유화되기 전 초기 상태의 아밀로이드베타 단백질에 더 잘 결합하는 것으로 확인됐다.
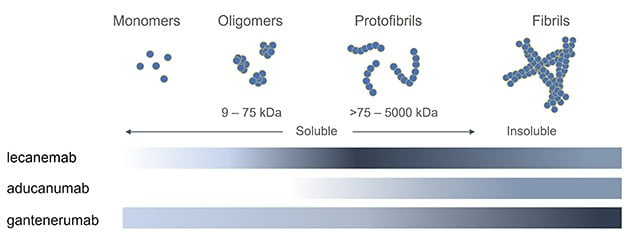
아밀로이드베타 단백질은 생성 초기에는 낱개로 존재하다 개수가 늘어나게 되면 서로 달라붙으며 점점 덩어리가 커지게 된다. 알츠하이머병을 유발하는 신경독성은 단백질 섬유가 엉켜 만들어지는 응집체가 되기 이전 단계인 원섬유(protofibril) 단계에서도 나타난다는 사실이 밝혀진 바 있다(DOI:10.3390/ijms21030952).
바이오아크틱 관계자에 따르면 이미 플라크 상태가 된 아밀로이드베타 단백질에서만 결합성을 보이는 아두헬름과 달리 레카네맙은 원섬유 단계에도 높은 친화력으로 결합할 수 있다. 가령 75~300kDa(킬로달톤) 크기의 작은 원섬유에서 레카네맙은 아두카누맙에 비해 100배 더 강하게 결합했다. 이보다 더 큰 300~500kDa 크기의 원섬유에서도 25배 이상 강하게 결합했다. 아두카누맙의 결합력은 로슈의 경쟁 파이프라인인 간테네루맙에 비해서도 결합력이 약한 것으로 나타났다.
문제는 효능 입증이다. 초기 알츠하이머병 환자 856명을 대상으로 한 임상 2상에서 레카네맙은 1차 평가지표를 만족하지 못했다. 1차 평가지표는 12개월 후 알츠하이머병 종합점수(ADCOMS)에서의 기준 이상 변화였다. ADCOMS는 알츠하이머병 환자의 인지 장애 정도를 평가할 수 있는 방법이다. 아두헬름의 1차 평가지표였던 치매임상평가척도박스총점(CDR-SB)을 포함하는 상위 알츠하이머병 평가 방법이다.
하지만 긍정적인 의견도 있다. 바이오젠은 레카네맙은 비록 1차 평가지표를 만족하지는 못했으나, 바이오젠이 공개한 추가 데이터에 따르면 초기 알츠하이머병 환자들을 12개월 대신 18개월을 추가한 결과, 아두헬름 및 도나네맙(릴리)과 비슷한 수준으로 초기 알츠하이머병 환자들의 인지 저하 속도를 늦추는 것으로 확인됐다. 기간이 늘어날 수록 위약과의 차이가 벌어져 18개월 시점에선 위약 대비 레카네맙이 우월할 확률이 98%를 기록했다.
레카네맙의 2차 평가지표 또한 아두헬름의 임상과 다르게 구성했다. 임상 3상에서 아두헬름의 평가지표는 1차 평가지표와 마찬가지로 알츠하이머병 환자의 인지능력과 기억능력, 일상생활 등을 평가하는 세부지표로 구성했었다. 환자의 인지행동 개선 여부를 확인하는 1차·2차 지표에서 모두 유의미한 결과가 나오지 않자 FDA는 뇌내 타우 단백질의 변화라는 대리 지표를 근거해 아두헬름을 승인했다.
레카네맙은 뇌내 아밀로이드 단백질의 변화와 바이오마커인 타우 단백질의 변화, 뇌 용적 변화 등을 2차 평가지표에 포함하는 전략을 택했다. 그 결과, 임상 2상에서 레카네맙은 1차 지표는 달성하지 못했지만 바이오마커 단백질의 유의미한 변화를 확인해 2차 평가지표를 달성했다.
특히 치료 효과와 바이오마커 변화를 함께 확인할 수 있었다는 점도 주요했다. 2년 동안 투약 환자들을 추적한 결과, 투약을 중단한 후에도 아밀로이드베타 플라크의 양이 감소된 채로 유지됐으며, 감소량이 큰 환자일수록 인지 저하의 속도가 더뎌지는 상관관계를 확인했다. 아밀로이드베타 플라크의 감소와 인지 능력간 유의미한 상관관계를 보이지 못한 아두헬름의 임상 3상 결과와 대조된다.
내약성 및 부작용 면에선 레카네맙이 아두헬름보다 나은 모습을 보였다. 주요 부작용은 뇌내에 체액이 고여 붓는 부종을 뜻하는 ‘ARIA-E’였다. 최고용량 임상시험에서 시험 참가자 중 10% 미만에게서 ARIA-E가 발생했다. 아두헬름은 임상3상에 참여한 환자 1029명 중 35%(362명)에게서 ARIA-E가 나타난 바 있다.
바이오젠은 50~90세 알츠하이머병 환자 1766명을 대상으로 레카네맙의 임상 3상을 진행 중이며 클리니컬트라이얼즈에 보고한 바에 따르면 오는 9월 종료된다. 아두헬름이 미국 정부 건강보험 메디케어로부터 다인종 임상 데이터가 부족하다는 지적을 받았던 만큼, 레카네맙의 임상 3상은 참여하는 인종을 다양화했다. 임상 2상에선 참여 환자 중 90%가 백인이었으나, 임상 3상은 아시아인 17%, 히스패닉 13%, 흑인 3%를 할당했다.
이우상 기자 idol@hankyung.com