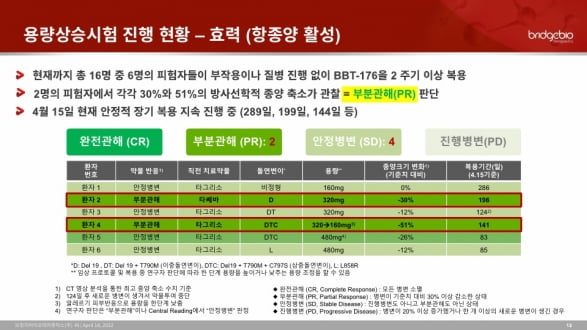
총 16명 중 6명, 질병 진행 없이 투약 지속
2명에게서 부분관해 나타나
회사는 전날 기업설명회에서 이 같은 내용을 공개했다.
BBT-176는 신규 상피세포성장인자수용체 티로신인산화효소 억제제(EGFR TKI)다. 중간결과를 공개한 이번 1상은 기존 표적 항암 치료에도 내성으로 질병이 진행되는 말기 비소세포폐암 환자가 대상이다. 항종양 활성 및 내약성, 안전성 등을 평가한다. 국내 3개 기관에서 진행되고 있다.
브릿지바이오에 따르면 현재까지 피험자 16명 중 6명은 질병의 추가적인 진행 없이 두 번의 주기(6주) 이상 BBT-176을 복용했거나 현재까지 투약을 지속하고 있다. 2명의 피험자는 방사선학적으로 종양의 크기가 각각 51%와 30% 감소해, PR 사례로 확인됐다는 설명이다.
종양 크기 감소가 51%로 관찰된 환자는 ‘C797S’를 포함한 삼중 돌연변이를 보유한 환자다, BBT-176이 표적하는 C797S 양성 삼중 돌연변이에서 유의미한 항종양 활성을 확인했고, 현재 141일째 약물을 투여 중이라고 했다.
이와 함께 병변이 더 악화하지 않는 ‘안정 병변(SD)’ 상태를 유지하면서 최대 289일 이상 장기 복용하는 피험자 등의 사례도 관찰됐다고 전했다.
또 용량상승시험의 다섯 번째 용량군에서 최대 480mg까지 투여했을 때 용량제한독성(DLT)이 관찰되지 않아, 관리 가능한 수준의 안전성을 보였다고 했다. 주요 이상반응은 구토, 메스꺼움, 설사, 피부 홍조 등으로 표적치료제에서 전형적으로 발생하는 항목들이었다.
모든 환자에서 BBT-176를 복용한 후 용량의존적으로 혈중 노출 농도가 증가하는 경향을 보여, 약물의 내약성 및 약동학적 특성을 확인했다고도 했다. 브릿지바이오테라퓨틱스는 다섯 번째 용량군에서 3명의 환자를 추가로 모집해, 최대 내약용량(MTD)과 2상 권장용량(RP2D)을 확정할 계획이다.
회사는 이번 1상 용량상승시험에서 BBT-176의 효능과 안전성을 확인한 만큼, 1상이 마무리된 이후 미국 식품의약국(FDA)에 ‘임상 1상 종료 회의(End of Phase 1 Meeting)’를 신청할 예정이다. 긴밀한 협의를 거쳐 2상 결과만으로 시판이 가능한 가속 승인(Accelerated Approval)을 위한 단계에 돌입할 계획이다.
임종진 브릿지바이오테라퓨틱스 부사장은 “3세대 표적 항암 치료 이후 나타나는 내성에 대한 치료제가 없는 상황에서 BBT-176이 C797S 삼중 돌연변이를 표적하는 항종양 효력 및 내약성 등을 확인한 것은 고무적”이라며 “신속한 후속 임상 진입과 FDA 가속 승인 등 다양한 전략을 강구할 것”이라고 말했다.
한편, 2020년 베링거인겔하임으로부터 기술반환된 특발성폐섬유증 신약후보물질 ‘BBT-877’에 대한 미국 식품의약국(FDA)과의 'C유형(타입C)' 회의 결과는 2분기 중 발표될 예정이다. 브릿지바이오테라퓨틱스는 긍정적인 결과를 확인하면 바로 2상을 개시한다는 목표다.
김예나 기자