에이비엘, 아이맵과 ‘ABL111’ 美 1상 중
8일 업계에 따르면 하버바이오메드는 전날 클라우딘18.2와 'CD3'를 표적하는 이중항체치료제 ‘HBM7022’를 아스트라제네카(AZ)에 기술이전했다고 밝혔다. 전임상 단계의 물질이며 총 계약 규모는 계약금 2500만달러(약 304억원)를 포함해 총 3억5000만달러(약 4265억원)다. 이날 홍콩 증시에서 하버바이오메드 주가는 전일보다 13.24% 급등했다.
클라우딘18.2는 위암 췌장암 식도암 폐암 등의 1차 병변 및 전이 부위에서 특이적으로 발현되는 단백질이다.
HBM7022는 암세포와 T세포를 결합시켜 항암 효과를 높이는 이중항체다. CD3 항체는 T세포의 CD3을, 클라우딘18.2 항체는 암세포의 클라우딘18.2와 결합한다. T세포와 암세포의 물리적인 거리를 좁혀 T세포에 의한 항암 효과를 높이는 기전이다.
전임상 결과, 시험관 내에서 HBM7022는 클라우딘18.2가 높게 발현된 종양세포주를 선택적으로 사멸시켰다. 또 사이토카인폭풍 증후군의 원인이 되는 인터루킨6(IL)을 거의 방출하지 않는 것을 확인했다.
하버바이오메드는 ‘위 인환세포암 세포주(NUGC4)’를 이식한 쥐에 HBM7022를 투여한 결과 암의 크기가 줄어드는 것도 확인했다. HBM7022 고용량 투여군에서는 단독항체 투여 대비 위 종양의 크기가 거의 증가하지 않았다.
하버바이오메드는 HBM7022을 클라우딘18.2 양성 위암 및 췌장암, 클라우딘18.2 돌연변이 위암 치료제로 개발할 수 있을 것으로 기대 중이다.
4-1BB·클라우딘18.2 항체 붙인 'ABL111'
에이비엘바이오의 ABL111은 클라우딘18.2와 함께 4-1BB를 표적한다. 4-1BB는 T세포를 자극해 암세포를 제거하도록 돕는 면역활성 단백질이다.앞서 BMS는 4-1BB 항체치료제를 면역항암제 ‘옵디보’와 병용투여하는 방식으로 개발했지만, 간독성이 나타나며 임상을 포기했다. 화이자는 간독성 반응이 낮은 항체를 선택했지만 T세포 활성화 효과가 떨어져 임상을 중단했다.
에이비엘바이오는 4-1BB 항체의 독성 우려를 최소화하기 위해 이중항체 방식을 택했다. 4-1BB 항체에 위암과 췌장암에서 특이적으로 발현되는 클라우딘18.2를 표적하는 항체를 붙여 특정 환경에서만 약효가 나타나게 만든 것이다.
ABL111은 아이맵이 보유한 클라우딘18.2 항체와 에이비엘바이오의 4-1BB 항체를 에이비엘바이오의 플랫폼 기술인 '그랩바디T'로 연결했다.
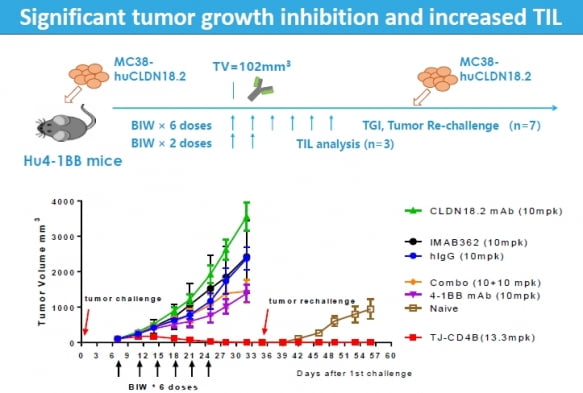
4-1BB를 발현시킨 쥐에 ‘클라우딘18.2 발현 대장암 세포주(MC38-hCLDN18.2)’를 주입했다. 종양 크기가 평균 102㎟가 됐을 때 연구진은 각각의 쥐에 ABL111, 클라우딘18.2 단독항체, 4-1BB단독항체, 인간 이뮤노글로불린(G) 등을 주 2회에 걸쳐 총 6회 투여했다.
그 결과 ABL111 투여군에서는 다른 투여군과 비교해 암세포가 거의 늘어나지 않았다. 시간이 경과한 후 클라우딘18.2 대장암 세포주를 새롭게 주입했을 때도, ABL111 투여군의 암세포는 커지지 않았다.

에이비엘바이오 관계자는 "클라우딘18.2에 붙이는 항체가 달라 하버바이오메드와의 직접 비교는 어렵다"면서도 "ABL111은 앞선 단계인 미국 임상 1상을 순조롭게 진행 중"이라고 말했다.
ABL111에 대한 중국 권리는 아이맵이, 한국 권리는 에이비엘바이오가 보유했다. 나머지 지역에 대한 글로벌 권리는 양사가 공동 보유한다.
ABL111은 지난달 미국에서 위암(위식도 접합부 암 포함)에 대해 희귀의약품으로 지정됐다. 에이비엘바이오와 아이맵은 ABL-111의 임상 1상 중간결과 발표 이후 기술이전을 목표하고 있다. 현재 임상 1상에서 용량 상승(dose escalation) 단계를 진행 중이다. 임상 1상 종료 시점은 연말이나 내년 초로 보고 있다.
박인혁 기자