체외진단 등 신의료기술 의료현장 진입 한층 수월해진다
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
복지부 규칙 개정…신의료기술 평가 유예 확대해 신기술 시장 선진입 유도

체외진단 기술 등 안전성 우려가 적은 신의료기술은 정부가 정식으로 평가를 시작하기 전이라도 의료 현장에서 쓰일 수 있게 됐다.
보건복지부는 27일 '선진입 의료기술'의 범위를 확대하는 내용의 신의료기술 평가에 관한 규칙' 개정안을 28일부터 시행한다고 밝혔다.
정부는 새로운 의료기술이 나오면 이 기술을 활용한 의료행위가 임상적 안정성·유효성을 갖추었는지를 확인하기 위해 '신의료기술평가'를 시행하고 있다.
그러나 조기에 임상 도입이 필요하다고 판단되면, 기술 평가를 유예하고 의료현장에서 먼저 사용할 수 있도록 기회를 주고 있다.
복지부는 이번 규칙 개정을 통해 이같은 선진입 가능 기술의 범위를 대폭 확대했다.
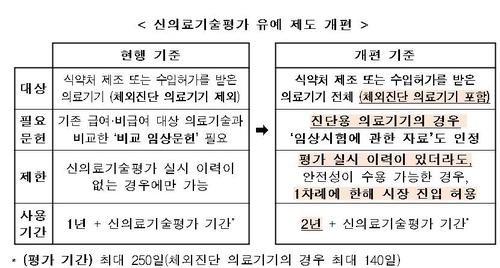
식품의약품 제조 또는 수입 허가를 받은 의료기기 전체가 평가 유예 대상이 될 수 있도록 했고, 체외진단기기 항목도 대상에 새로 포함됐다.
유예 기간은 현행 1년에서 2년으로 늘어났다.
또 기존에는 신의료기술 평가를 받지 않은 기술만 유예 혜택을 볼 수 있었지만, 앞으로는 평가 이력이 있더라도 안전성 측면에서 수용 가능한 범위인 경우 1차례에 한해 시장 진입이 허용된다.
유예 신청을 할 때는 현재의 의료기술과 신기술을 비교한 임상시험 결과(비교 임상문헌)를 제출해야 하지만, 안전 우려가 적은 진단용 의료기기에 대해서는 '임상시험에 관한 자료'만 제출해도 심사가 가능하다.
선진입 기술의 안전관리 체계는 강화된다.
그간 '평가유예 신의료기술', '제한적 의료기술', '혁신의료기술'을 각각 심의하던 위원회를 '근거창출전문위원회'로 일원화해 선진입 기술의 안전성을 엄격하게 검토한다.
또 선진입 기술 사용 중 발생한 심각한 부작용은 의무적으로 보고하도록 했고, 사용 중단 기준도 구체화했다.
복지부는 "의료기술의 발전을 촉진하고 국민들의 건강을 보호하기 위해 안전성 우려가 적은 의료기술이 현장에 빠르게 진입할 수 있도록 규제를 개선했다"며 "선진입 의료기술이 안전하게 제공되게끔 관리에 만전을 기하겠다"고 밝혔다.
/연합뉴스

보건복지부는 27일 '선진입 의료기술'의 범위를 확대하는 내용의 신의료기술 평가에 관한 규칙' 개정안을 28일부터 시행한다고 밝혔다.
정부는 새로운 의료기술이 나오면 이 기술을 활용한 의료행위가 임상적 안정성·유효성을 갖추었는지를 확인하기 위해 '신의료기술평가'를 시행하고 있다.
그러나 조기에 임상 도입이 필요하다고 판단되면, 기술 평가를 유예하고 의료현장에서 먼저 사용할 수 있도록 기회를 주고 있다.
복지부는 이번 규칙 개정을 통해 이같은 선진입 가능 기술의 범위를 대폭 확대했다.
식품의약품 제조 또는 수입 허가를 받은 의료기기 전체가 평가 유예 대상이 될 수 있도록 했고, 체외진단기기 항목도 대상에 새로 포함됐다.
유예 기간은 현행 1년에서 2년으로 늘어났다.
또 기존에는 신의료기술 평가를 받지 않은 기술만 유예 혜택을 볼 수 있었지만, 앞으로는 평가 이력이 있더라도 안전성 측면에서 수용 가능한 범위인 경우 1차례에 한해 시장 진입이 허용된다.
유예 신청을 할 때는 현재의 의료기술과 신기술을 비교한 임상시험 결과(비교 임상문헌)를 제출해야 하지만, 안전 우려가 적은 진단용 의료기기에 대해서는 '임상시험에 관한 자료'만 제출해도 심사가 가능하다.
선진입 기술의 안전관리 체계는 강화된다.
그간 '평가유예 신의료기술', '제한적 의료기술', '혁신의료기술'을 각각 심의하던 위원회를 '근거창출전문위원회'로 일원화해 선진입 기술의 안전성을 엄격하게 검토한다.
또 선진입 기술 사용 중 발생한 심각한 부작용은 의무적으로 보고하도록 했고, 사용 중단 기준도 구체화했다.
복지부는 "의료기술의 발전을 촉진하고 국민들의 건강을 보호하기 위해 안전성 우려가 적은 의료기술이 현장에 빠르게 진입할 수 있도록 규제를 개선했다"며 "선진입 의료기술이 안전하게 제공되게끔 관리에 만전을 기하겠다"고 밝혔다.


!['3일에 하루꼴'…지각 일삼아도 해고 안되는 '신의 직장' [곽용희의 인사노무노트]](https://img.hankyung.com/photo/202412/01.38945548.3.jpg)

![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


