[글로벌 시장 분석] 신약 개발 성공률을 높이는 동반진단
이번 보고서는 2011년부터 2020년까지 10년간 미국 식품의약국(FDA)의 시판허가를 받기 위한 임상개발 과제 9704건을 분석했다. 기업 주도의 상업화 임상시험이 대상으로, 연구자 임상은 제외됐다.
분석 결과 임상 1상 단계의 파이프라인이 승인까지 성공할 확률(LOA·Likelihood of Approval)은 7.9%였다. 평균 10년 6개월이 걸렸다. 가장 많이 실패하는 단계는 임상 2상이었다. 3상으로 넘어가는 비율은 28.9%에 불과했다. 이는 임상 1상에서 2상으로 들어가는 성공률 52.0%, 3상에 성공해 판매허가 신청서를 제출하는 비율 57.8%에 비해 크게 낮은 것이다.
임상 환자 모집에 바이오마커를 이용하면 승인 성공률이 15.9%로 전체 평균인 7.9%보다 크게 높았다. 바이오마커 식별을 통해 특정 치료제에 효과를 보일 환자를 선별하는 것이 성공률을 높이는 중요한 요인임을 보여준다.
바이오마커 활용 임상의 성공률은 임상 2상 단계에서 특히 높았다. 3상에 진입하는 비율이 46.3%로, 바이오마커가 없는 2상의 28.3%를 크게 뛰어넘었다. 3상에서 판매허가 신청에 도달하는 확률은 바이오마커 활용 임상이 68.2%였다. 비활용 임상 57.1%보다 높게 나타났다. 임상 1상 성공률의 경우 바이오마커 활용 여부와 상관없이 모두 52%대로 별 차이가 없었다.
지난 10년간 승인된 항암제에서 비(非)표적 치료제의 수는 감소한 반면, 표적항암제와 바이오마커의 사용은 증가했다. 2016년과 지난해 사이에 승인된 항암제의 85%, 136개는 표적치료제였다. 또 37%인 51개는 유전자 돌연변이나 종양 특이항원을 바이오마커로 사용했다.
동반진단, 개인 맞춤형 치료와 함께 성장
동반진단이란 환자에게 약물을 처방하거나 치료를 시행하기에 앞서, 치료법의 효과나 부작용을 예측할 수 있는 바이오마커를 검사하는 진단법을 말한다. 유전자 돌연변이 등을 겨냥하는 표적치료제의 발전과 함께 개인 맞춤형 치료의 필수요소가 됐다. 바이오마커란 단백질이나 디옥시리보핵산(DNA), 리보핵산(RNA) 등 몸 안의 변화를 알아낼 수 있는 생체지표다.
고액의 치료비가 필요한 항암 분야에서 동반진단이 가장 많이 사용되고 있다. 기존의 표준치료법은 동반진단 없이 다양한 항암제를 순차적으로 처방한다. 환자 개인별 특성을 반영하지 못하기 때문에 효과를 예측하기 힘들고, 부작용 발생 가능성도 높다. 동반진단과 표적치료를 이용하면 치료 효과는 높이고, 부작용을 줄일 수 있다. 바이오마커가 잘 알려진 유방암, 폐암, 대장암이 전체 동반진단 시장의 72%를 차지하는 것으로 추산된다.
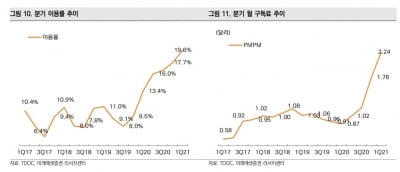
시장조사기관 마켓츠앤드마켓츠에 따르면 세계 동반진단 시장은 2017년 22억 달러에서 2024년 73억 달러(약 8조 원)로 연평균 15.7%의 고성장이 예상된다. 환자에게는 치료 효과 극대화와 치료비 감소, 제약사에게는 의약품 성공 가능성 제고 및 개발비 절감이라는 이점이 있기 때문이다. 국가 입장에서도 의료비용을 아낄 수 있다.
FDA는 이 같은 중요성 때문에 2004년부터 임상시험에서의 동반진단 활용을 권고하고 있다. 2010년 켐제넥스의 백혈병 표적치료제 오마프로는 동반진단제가 명시되지 않았다는 이유로 승인이 거부됐다. 2014년 FDA는 표적치료제 개발에 동반진단을 의무화하는 지침을 내놨다.
또 신속허가 제도를 적용해 동반진단 치료법 개발을 독려하고 있다.
세계 1위 면역관문억제제 키트루다의 탄생도 동반진단의 힘이 컸다. 키트루다와 같은 PD-1 억제제인 BMS의 옵디보는 2009년 2월 첫 임상을 시작해 2014년 12월 흑색종 치료제로 FDA 허가를 받았다. MSD의 키트루다는 20011년 3월 임상을 개시했으나, 혁신치료제 지정을 통해 2014년 9월 흑색종 승인을 받았다. 승인기간을 2년 단축해 첫 PD-1 면역항암제로 시장을 선점한 것이다.
두 약의 가장 큰 차이는 동반진단이다. 옵디보는 동반진단이 없었으나, 키트루다는 다코의 ‘PD-L1 IHC 22C3 pharmDx’ 동반진단법과 함께 임상을 시작했다.
최근에는 리제네론의 PD-1 억제제 리브타요가 애질런트의 동반진단법 ‘PD-L1 IHC 22C3 pharmDx assay’와 함께 진행성 비소세포폐암 치료제로 허가받았다.
현재와 같은 흐름은 동반진단 기업의 성장에도 긍정적이란 의견이 나온다. 국내 동반진단 기업인 엔젠바이오의 최대출 대표는 “동반진단은 처방 환자를 정하는 데 사용되기에 상용화가 되면 더 크게 성장하는 분야”라며 “실제 치료제 처방 건수보다 동반진단 건수가 더 많기 때문”이라고 말했다. 신약과 함께 개발할 경우, 임상시험용 제품 매출도 발생한다고 했다.
![[글로벌 시장 분석] 신약 개발 성공률을 높이는 동반진단](https://img.hankyung.com/photo/202103/01.25699202.1.png)
![[글로벌 시장 분석] 신약 개발 성공률을 높이는 동반진단](https://img.hankyung.com/photo/202103/01.25699201.1.png)
*이 기사는 <한경바이오인사이트> 매거진 2021년 3월호에 실렸습니다.
-
기사 스크랩
-
공유
-
프린트











![[단독] 홈플러스, 슈퍼마켓 사업 부문 매각한다](https://timg.hankyung.com/t/560x0/photo/202406/AA.36922731.3.jpg)
