美 콤패스, 에이비엘바이오서 도입한 항암 이중항체 美 2상 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
한독, 국내서 2상 1단계 진행
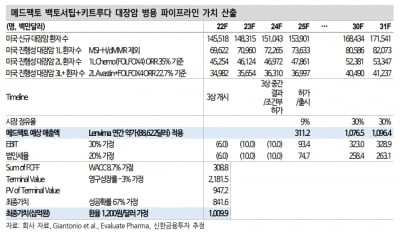
한독은 미국 콤패스 테라퓨틱스가 지난 18일(현지시간) 미국 식품의약국(FDA)으로부터 차세대 항암 치료제 ‘ABL001(CTX-009)’의 임상 2상을 승인받았다고 21일 밝혔다.
한독은 국내에서 담도암 환자 대상 ABL001(CTX-009)의 2상을 진행하고 있다. 이번 FDA 승인으로 임상이 글로벌 2상으로 확대됐다는 설명이다.
ABL001(CTX-009)은 이중항체 플랫폼 기술을 활용해 에이비엘바이오가 개발한 차세대 항암 치료제다. 한독과 콤패스는 각각 에이비엘바이오와 기술이전 계약을 맺었다. 한독은 한국 내 권리를, 콤패스는 한국과 중국을 제외한 글로벌 권리를 보유하고 있다.
이번 미국 2상 승인은 한독이 진행하고 있는 국내 2상의 1단계 연구 결과를 기반으로 빠르게 진행됐다고 했다. 한독과 콤패스는 한국 임상과 동일한 설계(프로토콜)인 미국 2상에 협력할 예정이다.
국내 2상은 ABL001(CTX-009)과 파클리탁셀의 병용 투여로 진행되고 있다. 절제 불가능한 진행성, 전이성 또는 재발성 담도암 환자 중에서 이전에 1차 또는 2차의 전신 항암치료를 받은 환자들을 대상으로 한다. 한독은 2상 1단계의 환자 등록을 마쳤다.
김영진 한독 회장은 “담도암 환자 대상 임상에서 ABL001(CTX-009)의 유의미한 데이터를 확인하고 있는 만큼, 콤패스와 협력해 성공적인 개발을 이끌 것”이라고 말했다.
토마스 슈츠 콤패스 최고경영자(CEO)는 “한국에서 시작된 임상을 올 2분기 미국에서도 시작해 담도암 환자를 대상으로 글로벌 임상을 본격화할 것”이라며 “담관암을 포함해 담도암에 있어 새롭고 중요한 치료법이 될 것으로 기대한다”고 했다.
김예나 기자
한독은 국내에서 담도암 환자 대상 ABL001(CTX-009)의 2상을 진행하고 있다. 이번 FDA 승인으로 임상이 글로벌 2상으로 확대됐다는 설명이다.
ABL001(CTX-009)은 이중항체 플랫폼 기술을 활용해 에이비엘바이오가 개발한 차세대 항암 치료제다. 한독과 콤패스는 각각 에이비엘바이오와 기술이전 계약을 맺었다. 한독은 한국 내 권리를, 콤패스는 한국과 중국을 제외한 글로벌 권리를 보유하고 있다.
이번 미국 2상 승인은 한독이 진행하고 있는 국내 2상의 1단계 연구 결과를 기반으로 빠르게 진행됐다고 했다. 한독과 콤패스는 한국 임상과 동일한 설계(프로토콜)인 미국 2상에 협력할 예정이다.
국내 2상은 ABL001(CTX-009)과 파클리탁셀의 병용 투여로 진행되고 있다. 절제 불가능한 진행성, 전이성 또는 재발성 담도암 환자 중에서 이전에 1차 또는 2차의 전신 항암치료를 받은 환자들을 대상으로 한다. 한독은 2상 1단계의 환자 등록을 마쳤다.
김영진 한독 회장은 “담도암 환자 대상 임상에서 ABL001(CTX-009)의 유의미한 데이터를 확인하고 있는 만큼, 콤패스와 협력해 성공적인 개발을 이끌 것”이라고 말했다.
토마스 슈츠 콤패스 최고경영자(CEO)는 “한국에서 시작된 임상을 올 2분기 미국에서도 시작해 담도암 환자를 대상으로 글로벌 임상을 본격화할 것”이라며 “담관암을 포함해 담도암에 있어 새롭고 중요한 치료법이 될 것으로 기대한다”고 했다.
김예나 기자
ADVERTISEMENT
ADVERTISEMENT



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


