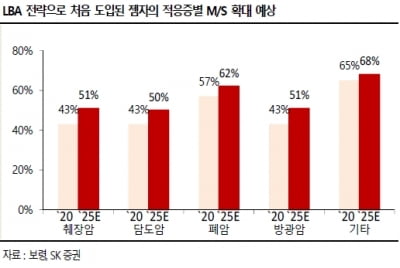
질병관리청은 29일 “조코바의 임상 결과를 다각적으로 검토 중”이라며 “임상 전문가 자문 등의 절차를 진행할 예정”이라고 밝혔다. 긴급사용승인은 코로나19 등 공중보건 위기 상황인 경우 정식 품목허가를 거치지 않고 의약품을 판매할 수 있는 제도다. 질병청이 전문가 회의 등을 거쳐 식품의약품안전처에 사용승인을 신청하면 식약처는 이를 토대로 승인 여부를 최종 결정한다.
시오노기는 지난 22일 일본 후생노동성으로부터 이 약의 현지 시판승인을 받았다. 조코바가 기침·발열·인후통 등 코로나19 증상 개선 소요 시간을 24.3시간 단축했다는 결과를 근거로 판단했다.
국내 승인 여부는 미지수다. 국내엔 화이자와 미국 머크(MSD)에서 개발한 먹는 코로나19 치료제가 이미 도입됐다. 다만 이들 치료제는 부작용 우려 등의 이유로 쓸 수 있는 환자폭이 넓지 않다. 질병청이 조코바를 대안으로 선택할 가능성도 있다.
이지현 기자 bluesky@hankyung.com