이는 미국에서 룩셉티닙을 개발 중인 앱토즈가 새로운 제형에 대한 약동학 샘플링을 통해 도출한 중간결과다.
룩셉티닙에 적용된 새로운 제형은 약물이 체내에 들어가 생체에 이용되는 비율인 생체이용률을 향상시키기 위해 개발됐다. 약물이 환자에게 더 많이 노출되면 임상시험에서 피험자에게 약물 투여량을 줄여 부작용 가능성을 감소시킬 수 있다고 회사 측은 강조했다.
앞서 앱토즈는 룩셉티닙의 급성골수성백혈병(AML) 대상 임상 1상에서 미세잔존질환(MRD) 기준으로 완전관해에 이른 사례를 미국혈액학회(ASH)에서 발표한 바 있다. 해당 사례가 나타난 피험자는 재발된 FLT30ITD 돌연변이의 AML를 앓고 있었다. MRD는 암세포의 크기가 0.01% 이하로 줄어야 완전관해라고 평가한다. 일반적인 완전관해 기준은 암세포의 크기가 5% 이하로 감소하면 중족된다.
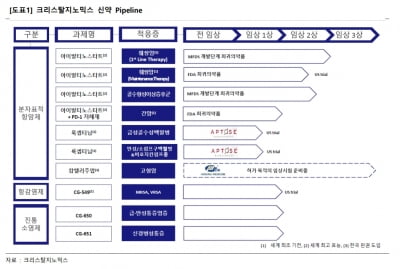
룩셉티닙은 FLT3과 BTK를 함께 저해하는 항암 신약 후보다. 앱토즈는 최대 5000억원을 내기로 하고 2016년 이 약물의 개발·상업화 권리를 도입해 미국에서 B세포 악성 림프종과 AML 환자를 대상으로 각각 임상시험을 하고 있다.
한경우 한경닷컴 기자 case@hankyung.com