"외산 CAR-T, 현실적으로 처방 어려워… 국산 개발 시급"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
큐로셀, 국내 유일 임상 1상 진입
앱클론, 1·2상 승인 대기 중
앱클론, 1·2상 승인 대기 중
‘기적의 항암제’, ‘4세대 항암제’.
기존 방식으로 치료가 어려운 혈액암 환자들을 완치시킨다고 알려진 '키메릭항원수용체-T세포(CAR-T)'에 붙여진 별명이다. CAR-T는 가장 강력한 면역세포로 알려진 T세포를 유전적으로 조작해 특정 암세포만을 제거하는 약물이다. ‘핵’과 같은 공격력을 가진 T세포에 유도 미사일처럼 암세포의 표면에 있는 단백질을 찾아 결합하는 항체가 합쳐진 형태다.
30일 업계에 따르면 올 3월 식품의약품안전처는 이런 가능성을 인정해, 노바티스의 ‘킴리아’를 국내 최초의 CAR-T 치료제로 승인했다. 혈액암 중 비교적 흔한 질병인 거대 B세포 림프종 치료에 쓰인다.
거대 B세포 림프종은 절반 이상의 환자가 암을 완전히 제거하는 데 성공하지만, 약 40%는 기존 치료법에 반응하지 않는다. 이런 환자들에게 킴리아는 희망의 치료제지만, 실제로 사용하기는 어려운 실정이다.
가장 큰 이유는 약물을 개발하는 데 걸리는 시간이다. 현재 승인되거나 임상시험에 진입한 CAR-T 치료제는 대부분 환자의 혈액을 이용한 ‘개인 맞춤형’ 치료제다. 미국에 제조 공장이 있는 킴리아의 경우 우선 환자의 혈액을 채취한 뒤 낮은 온도에서 얼려 미국으로 보낸다. 이후 혈액에서 T세포를 추출해 유전자 조작을 하고, 다시 얼려 한국으로 전달한다.
이 과정에 걸리는 시간은 최소 한 달. 환자에게 투여되기까지는 2~3주의 시간이 더 소요된다. 한시가 급한 환자들이 기다리기에는 긴 시간이다. 거대 B세포 림프종은 진행속도가 빨라 빠른 치료를 요구하는 공격성 혈액암에 속한다.
윤덕현 서울아산병원 종양내과 교수는 “하루라도 빨리 치료해야 하는 환자들에게 제작 기간만 한 달이 넘게 걸리는 치료제를 추천하기가 현실적으로 어렵다”며 “효능이 뛰어난 CAR-T 치료제가 개발됐음에도 국산 치료제 개발을 손꼽아 기다리는 이유”라고 말했다.
전문가들은 국산 CAR-T 치료제가 개발되면 투여까지 걸리는 시간이 2주 이상 줄어들 것으로 기대한다. 윤 교수는 “개발 기업과 병원과의 협력이 잘 이뤄진다면 미국에서 제조하는 것보다 빠른 시간 내에 환자 투여가 가능할 것으로 보고 있다”고 했다.
또 국내에서 치료제 생산이 이뤄지면 환자의 혈액이나 치료제를 동결할 필요가 없어 수율이 높아진다는 장점도 있다. 국내 CAR-T 개발기업인 앱클론 관계자는 “모든 세포치료제는 동결·해동 과정에서 일부 손상이 발생하게 된다”며 “이 과정을 생략할 수 있으면 수율뿐만 아니라 치료제의 효능도 유지할 수 있을 것”이라고 설명했다.
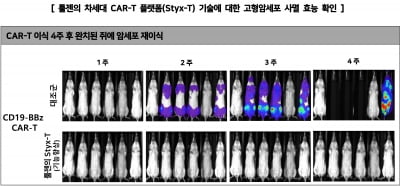
현재 국내 CAR-T 치료제 후보 중 임상 1상에 진입한 치료제는 큐로셀의 ‘CRC01’이 유일하다. 앱클론의 ‘AT101’은 지난 24일 식품의약품안전처에 국내 1·2상을 신청했다. 승인될 경우 내년 초부터 환자 투약이 시작될 예정이다.
두 물질 모두 킴리아와 동일하게 거대 B세포 림프종이 대상이다. 다만 AT101은 킴리아와는 다르게 인간화된 항체를 이용한다. 닭에서 얻은 항체를 기반으로 사람의 항체와 유사하게 유전적으로 조작한 것이다. 킴리아의 경우 쥐에서 얻은 항체를 이용한다. 정준호 서울대 의대 교수는 “CAR-T의 주요 부작용은 과도한 면역반응”이라며 “인간화된 항체는 면역원성을 현저히 낮출 수 있다”고 말했다.
임상의들이 국산 CAR-T 개발을 손꼽아 기다리는 또 다른 이유는 가격이다. 킴리아의 치료 비용은 5억원이 넘는다. 업계에서는 국산 CAR-T의 경우, 혈액의 동결과 이동 등에 필요한 비용이 절감되기 때문에 가격이 비교적 낮게 책정될 것으로 예상하고 있다.
업계 관계자는 “승인을 받는 국내 CAR-T 치료제가 늘면 건강보험적용도 수월해진다”며 “환자의 부담을 크게 줄일 수 있어 의료 현장에서는 건보 적용을 기다릴 수밖에 없다”고 했다.
현재 국내에서는 삼성서울병원이 지난 4월 CAR-T 치료센터를 개소하고, 국내 첫 CAR-T 투여에 성공했다. 서울아산병원 역시 CAR-T 치료를 위한 제조시설을 구축하고 있다.
최지원 기자
기존 방식으로 치료가 어려운 혈액암 환자들을 완치시킨다고 알려진 '키메릭항원수용체-T세포(CAR-T)'에 붙여진 별명이다. CAR-T는 가장 강력한 면역세포로 알려진 T세포를 유전적으로 조작해 특정 암세포만을 제거하는 약물이다. ‘핵’과 같은 공격력을 가진 T세포에 유도 미사일처럼 암세포의 표면에 있는 단백질을 찾아 결합하는 항체가 합쳐진 형태다.
30일 업계에 따르면 올 3월 식품의약품안전처는 이런 가능성을 인정해, 노바티스의 ‘킴리아’를 국내 최초의 CAR-T 치료제로 승인했다. 혈액암 중 비교적 흔한 질병인 거대 B세포 림프종 치료에 쓰인다.
거대 B세포 림프종은 절반 이상의 환자가 암을 완전히 제거하는 데 성공하지만, 약 40%는 기존 치료법에 반응하지 않는다. 이런 환자들에게 킴리아는 희망의 치료제지만, 실제로 사용하기는 어려운 실정이다.
가장 큰 이유는 약물을 개발하는 데 걸리는 시간이다. 현재 승인되거나 임상시험에 진입한 CAR-T 치료제는 대부분 환자의 혈액을 이용한 ‘개인 맞춤형’ 치료제다. 미국에 제조 공장이 있는 킴리아의 경우 우선 환자의 혈액을 채취한 뒤 낮은 온도에서 얼려 미국으로 보낸다. 이후 혈액에서 T세포를 추출해 유전자 조작을 하고, 다시 얼려 한국으로 전달한다.
이 과정에 걸리는 시간은 최소 한 달. 환자에게 투여되기까지는 2~3주의 시간이 더 소요된다. 한시가 급한 환자들이 기다리기에는 긴 시간이다. 거대 B세포 림프종은 진행속도가 빨라 빠른 치료를 요구하는 공격성 혈액암에 속한다.
윤덕현 서울아산병원 종양내과 교수는 “하루라도 빨리 치료해야 하는 환자들에게 제작 기간만 한 달이 넘게 걸리는 치료제를 추천하기가 현실적으로 어렵다”며 “효능이 뛰어난 CAR-T 치료제가 개발됐음에도 국산 치료제 개발을 손꼽아 기다리는 이유”라고 말했다.
전문가들은 국산 CAR-T 치료제가 개발되면 투여까지 걸리는 시간이 2주 이상 줄어들 것으로 기대한다. 윤 교수는 “개발 기업과 병원과의 협력이 잘 이뤄진다면 미국에서 제조하는 것보다 빠른 시간 내에 환자 투여가 가능할 것으로 보고 있다”고 했다.
또 국내에서 치료제 생산이 이뤄지면 환자의 혈액이나 치료제를 동결할 필요가 없어 수율이 높아진다는 장점도 있다. 국내 CAR-T 개발기업인 앱클론 관계자는 “모든 세포치료제는 동결·해동 과정에서 일부 손상이 발생하게 된다”며 “이 과정을 생략할 수 있으면 수율뿐만 아니라 치료제의 효능도 유지할 수 있을 것”이라고 설명했다.
현재 국내 CAR-T 치료제 후보 중 임상 1상에 진입한 치료제는 큐로셀의 ‘CRC01’이 유일하다. 앱클론의 ‘AT101’은 지난 24일 식품의약품안전처에 국내 1·2상을 신청했다. 승인될 경우 내년 초부터 환자 투약이 시작될 예정이다.
두 물질 모두 킴리아와 동일하게 거대 B세포 림프종이 대상이다. 다만 AT101은 킴리아와는 다르게 인간화된 항체를 이용한다. 닭에서 얻은 항체를 기반으로 사람의 항체와 유사하게 유전적으로 조작한 것이다. 킴리아의 경우 쥐에서 얻은 항체를 이용한다. 정준호 서울대 의대 교수는 “CAR-T의 주요 부작용은 과도한 면역반응”이라며 “인간화된 항체는 면역원성을 현저히 낮출 수 있다”고 말했다.
임상의들이 국산 CAR-T 개발을 손꼽아 기다리는 또 다른 이유는 가격이다. 킴리아의 치료 비용은 5억원이 넘는다. 업계에서는 국산 CAR-T의 경우, 혈액의 동결과 이동 등에 필요한 비용이 절감되기 때문에 가격이 비교적 낮게 책정될 것으로 예상하고 있다.
업계 관계자는 “승인을 받는 국내 CAR-T 치료제가 늘면 건강보험적용도 수월해진다”며 “환자의 부담을 크게 줄일 수 있어 의료 현장에서는 건보 적용을 기다릴 수밖에 없다”고 했다.
현재 국내에서는 삼성서울병원이 지난 4월 CAR-T 치료센터를 개소하고, 국내 첫 CAR-T 투여에 성공했다. 서울아산병원 역시 CAR-T 치료를 위한 제조시설을 구축하고 있다.
최지원 기자



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


